Серен оксид в природата и човешкия живот
В тази статия ще намерите информация за това какво представлява серния оксид. Ще бъдат разгледани основните му свойства от химична и физическа природа, съществуващи форми, методи за тяхното приготвяне и различия между тях. Ще бъдат споменати и областите на приложение и биологичната роля на този оксид в различните му форми.
Какво е същността
Серният оксид е съединение от прости вещества, сяра и кислород. Съществуват три форми на серни оксиди, които се различават по степента на S показана валентност, а именно: SO (монооксид, серен монооксид), SO2 (серен диоксид или серен диоксид) и SO3 (серен триоксид или анхидрид). Всички изброени варианти на серни оксиди имат сходни химически и физични характеристики.

Обща информация за серен монооксид
Двувалентният серен монооксид или серен монооксид е неорганично вещество състояща се от два прости елемента - сяра и кислород. Формулата е SO. При нормални условия, това е газ без цвят, но с остър и специфичен мирис. Реагира с воден разтвор. Много рядко съединение в земната атмосфера. За ефектите на температурата е нестабилна, съществува в димерна форма - S 2 O 2 . Понякога може да взаимодейства с кислород в резултат на реакцията, за да образува серен диоксид. Солта не се образува.
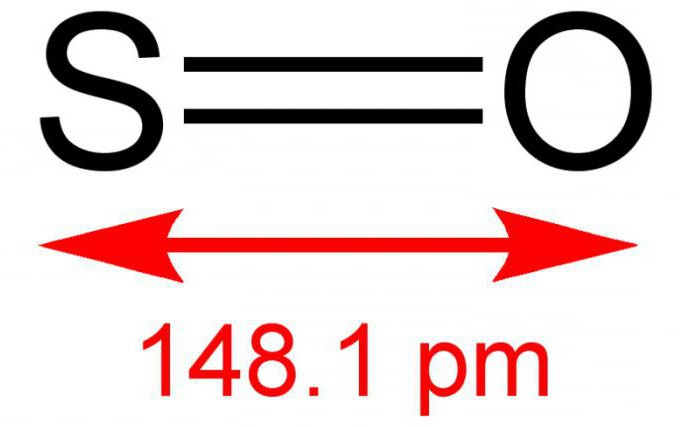
Серният оксид (2) обикновено се получава чрез изгаряне на сяра или разграждане на неговия анхидрид:
- 2S2 + O2 = 2SO;
- 2S02 = 2SO + 02.
Веществото се разтваря във вода. В резултат на това, серният оксид образува тиосулфатна киселина:
- S 2 O 2 + H 2 O = H 2 S 2 O 3 .
Обща информация за серен диоксид
Сярният оксид е друга форма на серни оксиди с химична формула SO 2 . Има неприятна миризма и няма цвят. Под налягане може да се запали при стайна температура. При разтваряне във вода образува нестабилна форма сярна киселина. Може да се разтвори в етанолови разтвори и сярна киселина. Той е компонент на вулканичен газ.
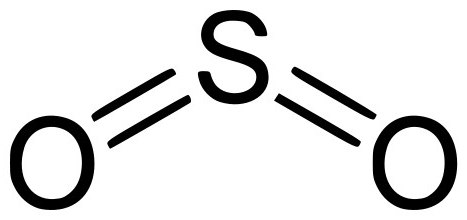
Промишлеността се произвежда чрез изгаряне на сяра или изгаряне на сулфидите:
- 2FeS 2 + 5O 2 = 2FeO + 4SO2.
В лабораториите, като правило, SO 2 се получава с помощта на сулфити и хидросулфити, излагайки ги на силни киселини, както и на метали с малка степен на активност на концентриран H2SO4.
Подобно на други серни оксиди, SO 2 е киселинен оксид. Взаимодействайки с алкали, образувайки различни сулфити, реагира с вода, създавайки сярна киселина.
SO2 е изключително активен и това е ясно изразено в неговите редуциращи свойства, където се повишава степента на окисление на серния оксид. Може да проявява окислителни свойства, ако е изложен на силно редуциращо средство. Последната характеристика се използва за производството на хипофосфорна киселина или за отделяне на S от газове от металургичната област на дейност.
Серният оксид (4) се използва широко от човека за производството на сярна киселина или нейни соли - това е неговата основна област на приложение. Той също така участва в процесите на винопроизводство и действа като консервант (Е220) там, понякога се използва за мариноване на растителни складове и складове, тъй като унищожава микроорганизмите. Материали, които не могат да бъдат избелени с хлор, се обработват със серен оксид.

SO2 е доста токсично съединение. Характерните симптоми, които показват отравяне, са кашлица, поява на проблеми с дишането, обикновено под формата на течащ нос, дрезгав глас, поява на необичаен вкус и възпалено гърло. Вдишването на такъв газ може да предизвика задушаване, увреждане на речевата способност на индивида, повръщане, затруднено преглъщане, както и белодробен оток в острата форма. Максимално допустимата концентрация на това вещество в работната стая е 10 mg / m 3 . Въпреки това, при различни хора, тялото може да проявява различна чувствителност към серен диоксид.
Общи данни за серния анхидрид
Серен диоксид или серен диоксид, както се нарича, е най-високият серен оксид с химическата формула SO 3 . Течност със задушаваща миризма, силно летлива при стандартни условия. Може да замръзне, образувайки смес от кристалния вид на неговите твърди модификации, при температура от 16,9 ° С и по-ниска.
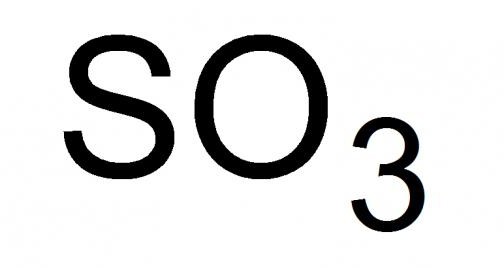
Подробен анализ на по-висок оксид
Когато S02 се окислява с въздух при високи температури, необходимо условие е наличието на катализатор, например V2O5, Fe2O3, NaVO3 или Pt.
Термично разлагане на сулфати или взаимодействие на озон и SO 2 :
- Fe2 (SO4) 3 = Fe2O3 + 3SO3;
- S02 + O3 = SO3 + O2.
Окисляване на SO 2 с NO 2 :
- S02 + NO2 = SO3 + NO.
Физическите качествени характеристики включват: наличието на плоска структура, тригонален тип и D 3h симетрия в състоянието на газа, по време на прехода от газ към кристал или течна форма на тример с циклична природа и зигзагообразна верига, има ковалентна полярна връзка.
В твърда форма, SO3 се намира в алфа, бета, гама и сигма форми, докато има съответно различна точка на топене, степен на полимеризация и различни кристални форми. Наличието на такъв брой типове SO3 се дължи на образуването на донорно-акцепторни връзки.
Свойствата на серния анхидрид включват много от неговите качества, основните от които са:
Способност за взаимодействие с основи и оксиди:
- 2HHO + SO3 = K2S04 + H20;
- СаО + SO3 = CaS04.
Най-високият сярен оксид SO 3 има доста голяма активност и създава сярна киселина, взаимодействаща с вода:
- SO3 + H20 = H2SO4 .
Реагира с хлороводород и образува хлорсулфатна киселина:
- S03 + НС1 = HSO3Cl.
За характеристика на серния оксид е проявлението на силни окислителни свойства.
Използването на сярен анхидрид е в създаването на сярна киселина. Малко количество от него се изпуска в околната среда по време на използването на серните пулове. SO 3 , образувайки сярна киселина след взаимодействие с влажна повърхност, унищожава различни опасни организми, като гъбички.
Обобщава
Серният оксид може да бъде в различни агрегативни състояния, започвайки с течност и завършвайки с твърда форма. Тя рядко се среща в природата и има много начини да се получи в индустрията, както и сфери, където може да се използва. Самият оксид има три форми, в които има различни степени на валентност. Той може да бъде много токсичен и да причини сериозни здравословни проблеми.