Redox. Редокс реакции: описание, примери
Редокс реакциите - редокс - представляват противоположно взаимодействие. В хода на тези явления се променят някои характеристики на компонентите. Тези взаимодействия се осъществяват чрез метода за преразпределение на електрони. Този процес протича между окисляващи атоми и редуциращи агенти. 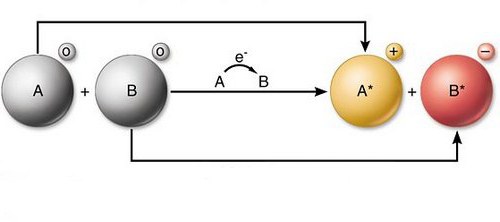
Свойства на компонентите
Органичната химия включва използването на широк спектър от окислители и редуциращи агенти. Това ви позволява да изберете специфичен реактив, който има селективност. Това означава, че компонентът може да влияе избирателно върху определени функционални категории. В допълнение, благодарение на тази широчина на избор, е възможно да се получат продукти в дадена степен на окисление. Така например, borogid Na не може да взаимодейства с естери и амиди. В същото време, той намалява алдехидите или кетоните в алкохоли. Сред втората група компоненти има и силно селективни съединения. Като пример, комплексът Cr03 и пиридин. Тази структура окислява алкохолите с висок добив до кетони. В тази връзка не се засяга комуникацията CC. SeO2 също е силно селективен. Съединението се окислява алдехиди и кетони към алфа дикарбонилни съединения.
Обща информация
Редокс реакциите предполагат различна промяна в свойствата на входящите компоненти. Това зависи от естеството на взаимодействието. По този начин, по време на редукцията, тя намалява и по време на окислението се увеличава. окислително състояние елементи. Първоначално терминът се тълкува достатъчно просто, за да се разбере. По този начин, окислението се счита за добавяне на кислород, възстановяването - отстраняването му, съответно. След въвеждането на електронни концепции в науката, дефиницията беше донякъде разширена. Оттогава концепцията се простира до взаимодействия, при които кислородът не участва. 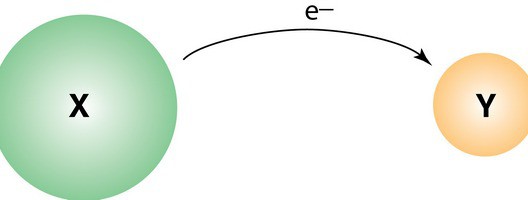
Характеристики на процеса
Редокс реакциите формално представляват движението на електроните. Компонентите от атома на един реагент се прехвърлят към атома на друг. Така че окислението, по-просто казано, е откатът на електроните. В някои случаи процесът в молекулата в оригиналното вещество може да стане нестабилен. В резултат на това той може да се разбие на по-малки компоненти, но с висока степен на стабилност. Атомите на окисляемите вещества обикновено се наричат донори на електрони, структурните елементи на окисляващия агент са съответно приеми. Продължава противоречивият процес на прикрепване на електрони. Нарича се възстановяване. При взаимодействието от този вид могат да се вземат различни елементи. Например, въглерод, водород и други. Различни съединения могат да бъдат възстановени. Например органични киселини в алкохоли и алдехиди. 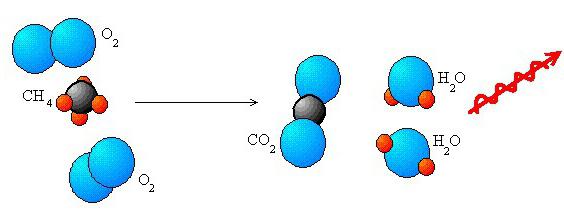
Видове редокс реакции
В съответствие с формалните характеристики на разглежданите взаимодействия се разделят на интра - и междумолекулни. Последните, например, включват 2SO2 + O2 → SO3. Също така окислително-редукционните реакции се класифицират като непропорционални и пропорционални. В първия случай един и същ елемент има различни свойства. По този начин един компонент може едновременно да бъде и редуциращ агент и окислител:
С2 + Н20 → НСО + НС1.
Друг вид - пропорционалност или пропорционалност - представлява няколко други взаимодействия. В такива реакции един елемент излиза от две различни състояния на окисление за един елемент:
NH4NO3 → N2O + 2H2O
Каталитични процеси
Вътре в тези взаимодействия се осигурява висока способност за селективност. Така например, в съответствие с катализатора и условията, ацетиленовите въглеводороди могат да бъдат селективно подложени на хидрогениране до наситен или етилен. А редукцията на CO 2 в CO на електрохимичен тип във водна среда в присъствието на 1,4,8,11-тетраазациклотетрадекан на никеловия комплекс дава възможност да се извърши процесът при по-ниски потенциали и едновременно с това да се потисне. електролиза на водата по време на образуването на Н2. Това взаимодействие има ключова стойност при превръщането през CO CO 2 в различни органични вещества.
стойност
Redox каталитични реакции природата изпълнява важни задачи в промишлеността. Те са доста широко разпространени в природата и се използват в машиностроенето. Също така, основата на живота са окислително-редукционни реакции, които възникват по време на транспорта на електроните, дихателната активност, фотосинтезата. Тези взаимодействия осигуряват по-голямата част от потреблението на енергия на хората чрез изгаряне на различни изкопаеми горива. 
Поток на взаимодействие
Често окислително-редукционните реакции са придружени от повишено енергийно отделяне. Това им позволява да се използват при получаване на електричество. Най-силни взаимодействия се наблюдават в отсъствието на разтворител. Ако са налице, такива реакции може да не се появят. Това може да се дължи на факта, че един или и двата компонента ще реагират с разтворителя. Можем да дадем следния пример. Във воден разтвор реакцията на 2Na + F 2 → 2NaF е невъзможна. Това се дължи именно на факта, че флуорът и натрият се отличават със силното си взаимодействие с Н 2 О. Образуването на комплекса е силно повлияно от свойствата на йони в окислително-редукционните реакции. Така например се случва с [C0 2 + (CN) 6 ] 4 -. Този комплекс се счита за силен редуциращ агент, за разлика от CO 2 + хидратния йон.
Органична химия. Редокс реакции
В тази дисциплина, прилагането на обобщени концепции и концепции за хода и естеството на процеса се счита за непродуктивно. Това е особено вярно в присъствието на лека полярност на междуатомната връзка. В органичната химия е обичайно окислението да се разглежда като процес на увеличаване на множествеността на съдържащата киселина или увеличаване на броя на водород-съдържащите връзки. В някои случаи се използва подход, който предполага, че различните степени на окисление се приписват на атомите С.

Това, от своя страна, зависи от броя на образуваните връзки с компонента с по-висока електронегативност от водород. В този случай, местоположението на функционалните производни ще се извършва по реда на увеличаване на окислителните състояния. Така например, наситените въглеводороди трябва да се приписват на нулевата група (чл. Oxid. - 4), ROH, RNH 2 , RCl - към първата (-2), R2CCl2 и R 2 CO - към 2 (0), RCCl 3 и RCONH 2 - до 3-то (+2), CO 2 и CCl 4 - до 4-то (+4). В този случай е ясно, че окислението е процес, при който съединенията се прехвърлят на по-високо ниво, а редукцията е обратната процедура. При изследването на взаимодействията трябва да се обърне специално внимание на механизмите, чрез които се случват процесите. Трябва да се отбележи, че тези фактори са много разнообразни. По този начин реакциите могат да се осъществят чрез хомолитичен или хетеролитичен механизъм. Обаче, в много случаи, процедурата на едноелектронно прехвърляне действа като начален етап на взаимодействието. Процесът на окисление, като правило, се характеризира с поток в позициите с най-висока плътност и редукция в местата, където електронната плътност е минимум.