Редокс потенциал: изчисление и измерване
Редокс потенциал (ОВП) е параметър, който описва нивото на окисление (окисление) и редукция на вещество. С други думи, способността за даряване или получаване на електрони в резултат на взаимодействието на химичните елементи зависи от естеството на процесите и условията на реакциите.

Кратко описание
Редокс потенциал - концепция, която в по-голяма степен отразява способността от дела (активността). Енергийният потенциал е енергия, която се натрупва и е готова за използване по всяко време. В момента, в който ще се използват всички химически съединения, които могат да бъдат подложени на окисление и редукция, системата ще достигне равновесно състояние. Най-често в такива случаи остава определена излишна енергия, която формира редукционния или окислителния потенциал на разтвора.
Ad
Образуването на ръжда е типичен пример за процес на окисление / редукция. Елементите, включени в този процес, претърпяват химически промени. Кислородът се комбинира с желязо, за да образува железен оксид (по-известен като ръжда): желязото претърпява окисление и кислородът се намалява. В резултат на това редокси потенциалът на системата "Fe / O 2 " става равновесен.

ORP вода
Чистата питейна вода е много важен фактор в живота, който често се забравя. За съжаление, има много малко абсолютно чисти питейни източници на животворна вода, произведени в индустриален мащаб за осигуряване на населени места. Следователно, водата, постъпваща във водоснабдителната система, трябва да се почисти и дезинфектира. Както се оказа, можете да използвате свойствата на ORP.
Ad
Редокс потенциалът на водата се измерва в миниволтове (mV). Този параметър показва активността на дезинфектанта, а не неговата концентрация, изразена в ppm. Химични съединения - хлор, бром, водороден пероксид, пероцетна киселина или озон - са високо ефективни оксидиращи агенти (но не винаги безопасни).
Те са способни да окисляват ("селекционират") електрони от други химически съединения и следователно са отлични дезинфектанти. Като причинява промени в химичното състояние на патогенните микроби, вредните водорасли и други органични вещества, дезинфектантът ги убива. На практика това означава, че обеззаразената вода с подходящо ниво на рН може не само да унищожи вредните бактерии, но и да се самоочисти от тях.
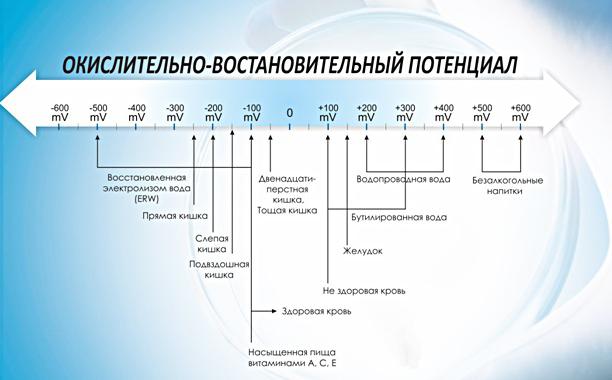
Стандарти за безопасност
През 1972 г. Световната здравна организация (СЗО) в регламентите относно стандартите за питейна вода установи, че при AFP 650 mV, водата се счита за дезинфекцирана и инактивирането на вирусите се осъществява почти моментално. Проучванията показват, че ако редокс потенциалът е 650 mV, бактериите Е. coli се унищожават незабавно или в рамките на няколко секунди. За унищожаването на по-устойчиви микроорганизми, като Listeria, Salmonella, дрожди и гъби, е необходимо ORP да е 750 mV или по-високо.
Ad
Как да се измери ORP
На практика, измерването на редокс потенциала се извършва със специални устройства. Принципът на работа на устройството за регистриране на ORP се основава на измерване на напрежението (в миниволтите, mV) в електрическа верига, образувана от сребърен електрод (отрицателен полюс) и платинен лентов електрод (положителен полюс). Могат да се използват и други материали, като графит и стъклен въглерод. Електродите на устройството се поставят във воден разтвор и след това се вземат показания.
Измерва се много малко напрежение (mV), което се създава, когато метал се поставя във вода, съдържаща оксидиращи и редуциращи вещества. Тези стойности на напрежение характеризират потенциала на окислителите, съдържащи се в течност.

Възможни ограничения
Не е възможно точно да се измери стандартния редокс потенциал, затова на практика ORP стойността на изследваната редокс-двойка се измерва по отношение на всяка стандартна полуреакция на сравнение и електрод, създаден на базата му (референтен електрод). Стандартната полуреакция трябва да е обратима и референтният електрод трябва да има постоянен и възпроизводим потенциал и да има сравнително проста структура.
Възможности за редокс електрод
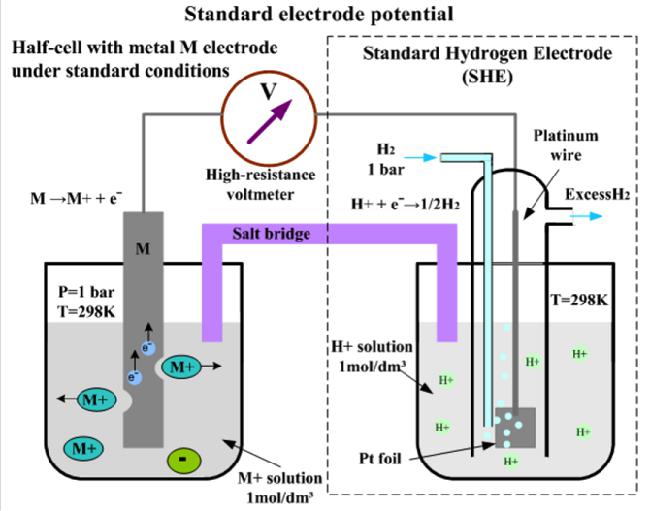
Стандартният водороден електрод, състоящ се от платинена лента, покрита със слой от платина (черна платина) и потопен в солен разтвор, се възприема от научната общност като универсален референтен електрод за измерване на ORP. (сярна) киселина с активността на химичните елементи йони на водорода, равна на едно: a H + = 1 .
Ad
Платината се промива с газообразен водород под налягане от 101,3 kPa (или 1 atm), което се сорбира върху порестата повърхност на платиновата черна. Обозначава се със стандартен водороден електрод: Pt (Н2) (р = 1 atm) НС1 ( Н + = 1) .
На повърхността на такъв обратимо работещ електрод се получава половин реакция: 2Н + + 2е 2 Н 2 ↑ . Потенциал, който обикновено се приема при нула при всяка температура: E на SHE = 0 . Трябва да се отбележи, че SHE не е редокс електрод, а се отнася до така наречените електроди от първия вид. Техният потенциал зависи от активността на някои катиони - в показания пример, върху активността на водородните катиони.
Редокс реакции
IAD се нарича реакция с промяна в степента на окисление на реагентите. С тази промяна окислителни състояния възниква с прикрепването / освобождаването на електрони. Процесите на добавяне и откат на електрони се считат от учените като половината от реакциите на редукция и окисление, съответно:
- aOK 1 + ne В sOc 1 (възстановяване);
- bBoc 2 - ne ↔ dOk 2 (окисление).
Във всяка половин реакция елемент с по-висока степен на окисление се нарича окислена форма (ОК) и в по-ниска степен на окисление, редуцираната форма (Вос). Окислените / редуцирани форми на веществото са конюгирани редокси двойки, наречени редокси двойки. В окислената двойка окислената форма (ОК) е акцептор на електрони, редуцираната форма (Вос) е вид донор на електрони. Редукционните / окислителните полу-реакции не са осъществими поотделно - ако е налице електронен донор, тогава трябва да присъства и акцептор.
Стандартна ORP
Ако потенциалът на изследваната редокс-двойка се измерва при стандартизирани условия, температурата е 25 (С (298 K), налягането е 1 atm (101.3 kPa) и активността на окислените и редуцираните форми е равна на единица ( ok = a sun = 1 mol / l ) нарича се „стандартен редокс потенциал“ и е обозначен като: E 0 прибл. / Vos .
Ad
Потенциална таблица
Стандартно редокс-потенциалните комплекти от редокси-двойки от учени, измерени на практика. Стойностите им в волтове се показват в таблица с редокс потенциали:
Двойка OB (OK / VOS) | E 0 Ok / Vos | Двойка OB (OK / VOS) | E 0 Ok / Vos |
2Н + / Н2 | 0.00 | F 2 / 2F - | 2.28 |
S0 / H2S | -0,14 | МпЮ 4 / Mn 2+ | 1.51 |
Fe 2+ / Fe 0 | -0,47 | Cl 2 / 2Cl - | 1.36 |
Zn 2+ / Zn 0 | -0,76 | Fe 3+ / Fe 2+ | 0.77 |
Al 3+ / Al0 | -1,61 | I 2 / 2I - | 0.54 |
Mg 2+ / Mg 0 | -2,07 | Sn 4+ / Sn 2+ | 0.15 |
Стойности за декодиране
Колкото по-голям е редокс-потенциалът на Е0 ОК / Вос , толкова по-окислена е формата и съответно редуцираната форма има по-слаба редукционна функция. И обратно, колкото по-малък е О 0 / Vо , толкова по-силна е възстановената форма.
Положителният знак на потенциала показва спонтанна реакция на редукция в тандем с SHE, а отрицателна - спонтанна окислителна реакция. Потенциалът на силните окислителни агенти винаги ще бъде положителен, а силните редуциращи агенти ще бъдат отрицателни.
Таблицата на редокс потенциалите показва, че молекулярният флуор има най-големите окислителни свойства, а металните магнезий имат най-големите редукционни свойства. при тези йони Флуорът и магнезият на практика нямат съответно редуциращи и окислителни свойства.
Уравнение на Нернст
Потенциалът на системата зависи от съотношенията на концентрациите на редуцираните и окислени форми на веществата, участващи във взаимодействието, температурата на околната среда, свойствата на разтворителя, рН на разтвора и други фактори. Изчисляването на редокси потенциала, изразен чрез зависимостта на потенциала от състава на разтвора, показва уравнението на Нернст:
E Ok / Boc = E 0 Ok / Boc + (RT / nF) × ln (aOk / aBoc), където
- E Ok / Vos - реална половин реакция на AFP (редокс двойки).
- E 0 Ok / Vos - стандартна ORP половин реакция (редокси двойки).
- n е броят на електроните на ОВ реакцията.
- R = 8,314 J / mol x K (моларна газова константа).
- F = 96500 С / mol (брой на Фарадей).
- T е абсолютната температура (в K).
Възстановяване и окисление
Редокс реакциите се определят от степента на окисление и редукция. Окисляването се отнася до процеси, при които атоми, молекули или йони даряват електрони. И възстановяване - когато атоми, молекули или йони придобиват електрони.
Съответно, окислителите са вещества, които свързват електрони (О2, халогени, HNO 3 , KMnO 4 ) и редуциращи агенти, които даряват електрони на други атоми по време на окислително-редукционния процес (Н2, метали, HI). Давайки електрони на други, редуциращите агенти се окисляват, а окислителните агенти, приемащи електрони от други участници в реакцията, се редуцират: 2FeCl 2 + Cl 2 → 2FeCl 3 .
Състояние на окисляване
Това е зарядът, който един атом в химичното съединение би притежавал, ако електроните на всяка химична връзка, образувана от него, бяха напълно изместени към по-електроотрицателен атом. Например:
- FeCl2: Fe + 2 , 2Cl- 1 ;
- NaH: Na + l , H- 1 ;
- СС14: С + 4 , 4С1 -1 ;
- СН4: С- 4 , 4Н + 1 .
OVR може да включва частични или пълни преходи на електроните, степента на окисление на елементите се променя. Прилагат се следните правила:
- В едно просто вещество окислителното състояние на атома ще бъде нула (Cl 2 : 2 Cl 0 ).
- Степента на окисление на атомите от състава на молекулата също е нула.
- Степента на окисление на атомите на комплексния йон ще бъде равна на заряда на йона.
Определяне на редокс потенциала на почвата
AFP влияе директно върху структурата на почвата. За да се измери, електродът се залепва в мокра земя и се определя стойността в mV (миливолта) на специално устройство. В същото време в почвите се проявяват много процеси и редокс реакции на трансформации на активните химични елементи: органична материя, манган, желязо, сяра и азот.
Решаващо влияние върху състоянието на почвата оказва кислородът в две форми: разтворени във влагата на земята и атмосферното. Те са в равновесие. Също така при редокс процесите се намаляват веществата на микроорганизмите. Основните фактори, определящи фокуса и интензивността на АФП, са:
- Степента на влажност на почвата.
- Активност на микрофлората.
- Аерация на почвата.
- Съдържанието на органична материя.
Високите нива на AFP се характеризират с автоморфни почви:
- Серозем - 350-450 mV.
- Черноземи - 400-600 mV.
- Podzol - 550-750 mV.
При намаляване на потенциала за напояване.
ORP вина
При производството на вино неговата важна характеристика е редокс (редокс) потенциалът. Чрез контролиране на окислително-редукционния потенциал е възможно да се регулира или поне да се разбере значението на процесите, които „бушуват” по време на узряването на винените материали. Това са процесите на ферментация, редукция и окислителни реакции.
При контакт с кислород, самоокислителните системи се променят, което води до увеличаване на потенциала. Съответно, колкото по-дълъг е етапът на проветряване на винения материал, толкова по-голям е неговият редокс потенциал. Ако се спре достъпът до въздух, потенциалът постепенно намалява, достигайки определени стойности, наречени маргинален потенциал. Като правило газираните вина имат показатели от 350-500 mV, вина, които отлежават без достъп на въздух - 100-150 mV. Колкото по-дълго време е минало от бутилирането на алкохолната напитка в бутилки, толкова по-малко ще бъде нейният потенциал. Необходимо е да се отвори бутилката или да се разклати, коефициентът mV ще се увеличи драстично.
ORP в космически мащаб
Нормалният редокс потенциал исторически е бил определящ фактор в геоложката еволюция на Земята и други космически тела. Основният окислител в геоложките системи е кислород. Променливостта на кислорода (fO 2 ) е мярка за окислението на природните системи, независимо от наличието или отсъствието на газова фаза, съдържаща в тях свободен кислород. Променливостта на кислорода контролира поведението на много елементи в процесите на кондензация на протопланетния облак, по време на натрупването на планети и образуването на техните метални ядра. Тези знания помагат да се предвиди наличието на минерали.
Използването на AFP на практика
Измерването на ORP ви позволява да определите ефективността на дезинфекцията на водата, независимо от вида на използвания окислител или смес от дезинфекциращи съединения и други фактори. Резултатът от измерването информира дали процесът на дезинфекция е наистина ефективен. Измерването на водата ORP може да се извърши във всяка точка на системата, като по този начин се определя чистотата на водоизточника, тръбите, както и водопроводната инсталация.
Редокс потенциалът на всеки край на системата трябва да бъде по-висок от 650 mV. Ако ORP, измерен в края на системата, е по-малък от този в началото на системата, това показва, че водоснабдителната система не е добре почистена.
Използването на ORP ви позволява да намерите оптималния баланс между рН и съдържанието на несвързания хлор. точност измервателни уреди позволява да се намали нивото на хлор до такъв, при който няма риск от корозия. Например, ако ORP е 850 mV, нивото на хлора трябва да бъде понижено, а в случаите, когато стойността е 600 mV, нивото на рН и несвързания хлор трябва да бъдат проверени и съответно коригирани чрез намаляване на рН или увеличаване на присъствието на хлор.
Технологията ORP се използва в области като пречистване на вода (преди и след консумация), металообработка, дезинфекция на пресни зеленчуци и плодове, озониране на вода (търговски аквариуми, дезинфекция на вода), производство на вино, производство на белина, кланици в птицеферми, хартиена промишленост (избелване) целулоза), басейни, СПА. Температурата на водата не влияе на стойността на ORP.

