Амониев сулфид: производство, хидролиза, приложение
Азотът е един от най-важните елементи на органичната химия. Под формата на комплексни съединения елемент N е важна част от протеините, които съставляват всички живи организми на нашата планета. Този доста активен химичен елемент образува много съединения, единият от които е амониево съединение.
Какво е това?
В амонячната молекула азотът покрива неговата ковалентни връзки три водородни атома, последната електронна връзка остава свободна. По този начин, амонийът може да действа като донор на различни химични реакции, образувайки четвърта, не-прекарана ковалентна връзка с други вещества и съединения. Ако такова съединение се случи с водороден атом, се образува NH4 молекула. Полученият елемент може да реагира с различни киселини, които са в разтворена или концентрирана форма. При взаимодействието им амонякът ги неутрализира. В резултат на реакцията се получават амониеви соли - термично нестабилни съединения. ако амониева сол топлина, бързо се разлага на съставните си вещества. С повишаването на температурата амонякът се образува с киселина. Обратният процес също е възможен. Например, амониев сулфид може да бъде получен чрез взаимодействие с кисел сероводород.
формула
Това съединение е записано в химическите уравнения във формулите по-долу. 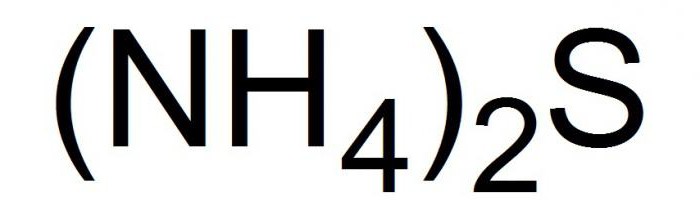 В свободно състояние амониевият сулфид е кристал. Или игли жълт цвят с ниска точка на топене. Второто име на съединението е амониев сулфид. Това съединение е лесно за приготвяне, но още по-лесно се губи - жълтите кристали са много летливи и бързо се разлагат при нормални условия.
В свободно състояние амониевият сулфид е кристал. Или игли жълт цвят с ниска точка на топене. Второто име на съединението е амониев сулфид. Това съединение е лесно за приготвяне, но още по-лесно се губи - жълтите кристали са много летливи и бързо се разлагат при нормални условия.

Общи химични реакции
Хидролизата на амониевия сулфид се различава от другите реакции на подобни соли, тъй като в нея участват както катиони, така и аниони от същото вещество. Реакционният процес зависи от температурата. Хидролизата на амониев сулфид може да бъде записана, както следва:
- уравнение на йонна хидролиза за катион:
NH4 + H20 = NH3 * H20 + H +; - Уравнението на анионната хидролиза протича в два етапа:
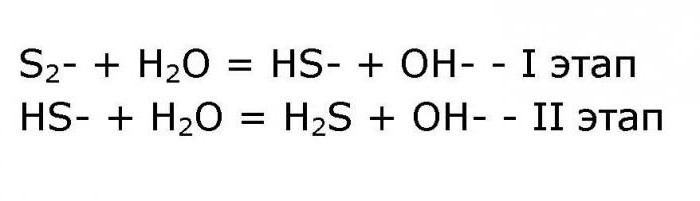
Крайното йонно уравнение на реакцията е както следва:
- NH4 + S2- + 2H20 = NH3 * Н20 + HS- + H + + OH-.
Стандартният запис за тази химична реакция е следният:
- (NH4) 2S + 2H2O = NH3 * H20 + NH4HS + H20.
Без загряване, реакцията може да бъде обратима и се появява в първия етап. Но ако веществото се нагрява, реакцията ще стане необратима - крайните вещества амоняк и сероводород просто оставят полето на взаимодействие и се изпаряват.
Получаване на амониев сулфид
Амониевият сулфид най-често се получава чрез взаимодействие на сероводорода с излишък от амоняк:
H2S + 2 NH3 → (NH4) 2S.
Едно от най-характерните характеристики на това съединение е пълното разлагане на съединението във вода. Веригата на химическата реакция изглежда, както следва:
(NH 4 ) 2 S → 2NH 4 + + S 2 -
NH4 + H20O NH3 H20 + H +
S 2 - + H 2 O - HS - + OH -
Амониевият сулфид във вода се разлага на амоняк и сероводород.

По-нататъшното разлагане се придружава от отделянето на водород и появата на амоняк, разтворен във вода и слаб HS - анион. Следователно, в таблиците, обясняващи разтворимостта на химичните елементи, амониевият сулфид се маркира с пропуск.
Практическо приложение
В промишлеността е разработено практическо приложение за изпаренията на амониев сулфид. Течната форма на това съединение се използва по време на транспортиране. Да се съхранява в затворени, химически инертни контейнери.

Това вещество е добре известно на фотографите и текстилните работници. При фотографията това съединение се използва за обработка на филм. При взаимодействие със силни основи се получава химическа реакция, придружена от освобождаване на вредни вещества. В текстилната промишленост амониевият сулфид се използва като компонент на избелващите смеси. Металурзите и реставраторите го използват успешно, за да превърнат патината в бронз. Амониевият сулфид със сигурност се използва в производството на карбамид, като важен тор, както и в производството на сода.
Може би използването на това вещество в икономическата дейност би било по-често. Но поради изключителната летливост на това съединение, той бързо реагира химически с водните пари във въздуха. Крайният продукт на това взаимодействие е сероводород, който е известен с острия си и много неприятен мирис. Именно тази характеристика на амониевия сулфид е довела до използването й в производството на продукти за практични шеги, включително „вонящи бомби“ и т.н.