Амониеви соли: свойства. Амониеви соли: приложение
Амонийът е едно от многото азотни съединения. Нейните соли имат редица интересни свойства и намират практическо приложение в много области на човешката дейност. Изследването на свойствата на този елемент се занимава с химия. Амониевите соли се изследват при изследването на взаимодействието на азот с други химични елементи. 
Какво е амоний
За да разберете какво е амоний, трябва по-добре да се запознаете с принципа на съчетаване на азотни и въглеродни атоми. Амонячната молекула е написана под формата на NH 3. Азотният атом е свързан с ковалентните си връзки с три протони. Поради вътрешната структура на азота, една връзка остава неразпределена. 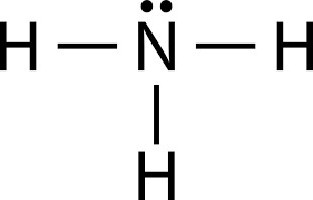
Следователно, NH 3 активно навлиза в различни ковалентни връзки с други елементи, използвайки неразпределената електронна двойка. Ако в съединението попадне водородно ядро, се образува амониев йон. Реакционната схема е показана по-долу: 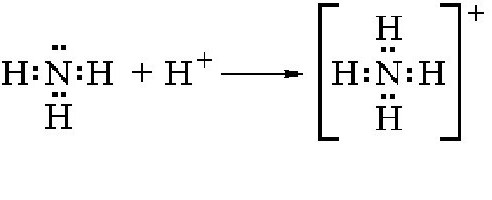
Както можете да видите, в тази реакция, амонячната молекула е акцептор на един протон и по този начин се държи като основа. Амонийът не съществува в свободната си форма, тъй като се разпада почти мигновено във водород и амоняк. Амониевите соли се получават в резултат на взаимодействието на този елемент с други вещества. Както се вижда от практическите експерименти, амонийът влиза в различни съединения с киселини, като ги неутрализира и образува амониеви соли. Например, в случай на реакция с солна киселина настъпва образуването на една от солите на този елемент:
NH3 + НС1 = NH4C1
Резултатът от реакцията е солен хлорид амониев.
Водно взаимодействие
Амонийът взаимодейства добре с вода. В резултат на реакцията се получават амонячни хидрати с повишена концентрация на ОН-. Запис от химическата реакция:
NH3 + H2O → NH4 + OH -
Тъй като броят на йони на хидроксигрупата е изключително голям, водните разтвори на амоняка имат алкална реакция. Обаче, съгласно стария химически навик, воден разтвор на амоняк се записва като NH4OH. Това вещество се нарича амониев хидроксид и алкалната реакция на това съединение се счита за дисоциация на молекули, в които се разлага амоняк.
Амониеви соли. Свойства и основни характеристики
Повечето от солите на NH4 са практически безцветни и доста разтворими във вода. Това съединение има много свойства на металите, следователно амониевите соли се държат по същия начин като соли на различни метали. Ето няколко примера за това сходство:
- NH 4 соли са добри електролити. Те се подлагат на хидролиза в различни разтвори. Тази реакция може да бъде проследена чрез примера на дисоциация на амониев хлорид:
NH4C1 = NH4 + + НС1 -
- Подлежат на хидролиза. Резултатът е реакция на сол на слаба основа и силна киселина :
- имат йонна кристална решетка, имат електрическа проводимост;
- не поддържат високи температури и се разпадат на компоненти.
Необратими и обратими процеси
Разлагането на амониеви соли под въздействието на температурата може да бъде необратимо или може да бъде обратим процес. Ако солта анион проявява слаби окислителни свойства, солта се разгражда обратимо. Амониевият хлорид е класически пример за такава реакция: с нарастване на температурата на реакцията, тя в крайна сметка се разгражда в свои оригинални елементи - хлороводород, както и амоняк. Ако стените на съда не се затоплят, на тях се появява нападение. Така се получава амониев хлорид. 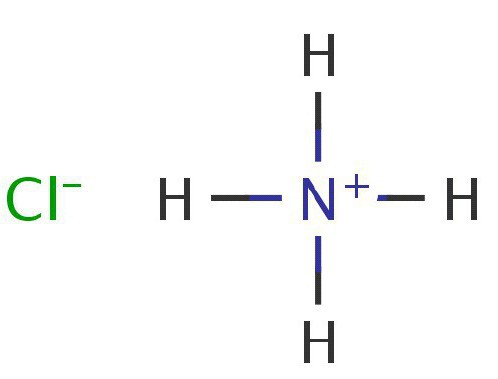
Други соли на този елемент, в които анионът има изразени оксидиращи свойства, се разгражда безвъзвратно. Стандартен пример за такава реакция е разлагането на амониев нитрат, което е както следва:
NH4NO3 = N2O + Н20
Тъй като един от продуктите на взаимодействието напуска полето, реакцията спира.
Използването на амонячни и амониеви соли
Значителна част от амоняка, добит в промишлеността, се използва за инсталации за замразяване и охлаждане. Амониевите соли се използват в ежедневието и в медицината. Но по-голямата част от амоняка отива за производство азотна киселина и различни азотсъдържащи съединения, предимно различни минерални торове.
Азотни торове
Най-известните соли на азотното производно, чието използване в стопанска дейност е изключително важно - то е амониев сулфат, амониев нитрат, амониев хлорид. Азотът е необходим компонент на протеините. Този елемент е задължителен за съществуването на всеки жив организъм. Растенията извличат азот от плодородна почва, където този елемент е предимно в свързана форма. Азотът обикновено се открива като амониеви соли и съединения на азотна киселина. Разтваряйки се във влажна почва, тези неорганични съединения влизат в растителните организми и се обработват от тях в различни протеини и аминокиселини. Животните и хората не могат да абсорбират азот или в свободна форма, или като прости съединения. За храненето и растежа им е необходим протеин, чийто компонент е задължително азот. Само с участието на растенията получаваме елемента, от който се нуждаем за живота и здравето.  Почвите в естествената среда съдържат малко количество азот. След прибирането на всяка култура, малкото количество азот, което преди това е било в почвата, се отвежда заедно с растенията. За ускоряване на процеса на регенерация на почвата и прилагане на азотни торове.
Почвите в естествената среда съдържат малко количество азот. След прибирането на всяка култура, малкото количество азот, което преди това е било в почвата, се отвежда заедно с растенията. За ускоряване на процеса на регенерация на почвата и прилагане на азотни торове.
Амониев сулфат. Формулата за това съединение е (NH4) 2 SO 4. Тази амониева сол формира основата за различни торове.
Амониев нитрат. Формулата за това вещество е NH4NO3. Също така е добре познат тор, който се абсорбира добре от растенията. В допълнение към селскостопанската употреба, амониевият нитрат се използва във военната и минната промишленост - на него се използват взривни смеси (амонални), използвани за взривяване. 
нишадър
Амониев хлорид. Известен като амоняк. Неговата химична формула е NH 4 Cl. Това съединение е добре известно в производството на бои и лакове, в текстилния бизнес, амонякът се използва в галванични клетки. Амониевият хлорид е добре познат на акционерите и миньорите. Те често използват амониево хлоридни соли в работата си. Използването на това вещество помага да се отстранят най-тънките оксидни филми от повърхността на металите. Докосването на нагретия метал към амоняка причинява съответната реакция на оксидите - те или отиват на хлориди, или се редуцират. Хлоридите бързо се изпаряват от металната повърхност. Процесът на реакция за мед може да бъде записан, както следва:
4CuO + 2NH4C1 = 3Cu + 2CuCl2 + N2 + 4H2O.
Амонякът в течна форма и силните разтвори на амониевите соли също се използват като азотни торове - съдържанието на азот в тях е по-високо, отколкото в твърдите торове и се усвоява по-добре от растенията.