Какво е бариев сулфат? Как да получите бариев сулфат?
Бариевият сулфат е неорганично вещество с химичната формула BaSO 4 . Това е бял прах, без мирис, неразтворим във вода. Нейната белота и непрозрачност, както и висока плътност определят основните области на приложение.
История на заглавието
Барий се отнася до алкалоземни метали. Последните се наричат така, защото, според Д. И. Менделеев, техните съединения образуват неразтворима маса на Земята, а оксидите "имат земен вид". Барийът естествено се намира под формата на баритен минерал, който е бариев сулфат с различни примеси.
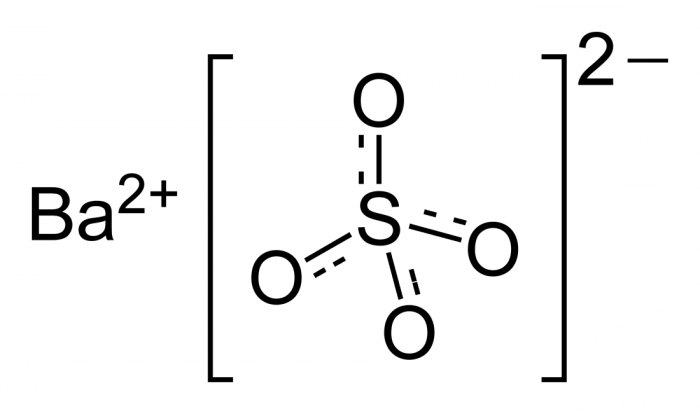
За първи път е открит от шведските химици Шееле и Ган през 1774 г. като част от т.нар. Оттук и името на минерала (от гръцки. "Baris" - тежък), а след това и самият метал, когато през 1808 г. е бил изолиран в чист вид от Humphry Devi.
Физични свойства
Тъй като BaSO 4 е сол на сярна киселина, нейните физични свойства са частично определени от самия метал, който е мек, химически активен и сребристо бял. Естественият барит е безцветен (понякога бял) и прозрачен. Химически чист BaSO 4 има цвят от бяло до бледожълто, не е запалим, с точка на топене 1580 ° C.

Каква е масата на бариевия сулфат? Моларната му маса е 233,43 g / mol. Той има необичайно високо специфично тегло - от 4,25 до 4,50 g / cm 3 . Като се има предвид неразтворимостта във вода, високата плътност го прави незаменим като пълнител за сондажни течности.
Химични свойства
BaSO 4 е едно от най-умерено разтворимите съединения във водата. Тя може да бъде получена от две силно разтворими соли. Взема се воден разтвор на натриев сулфат - Na2S04. му една молекула във вода се дисоциира на три йона: два Na + и един SO 4 2- .
Na 2 SO 4 → 2Na + + SO 4 2- 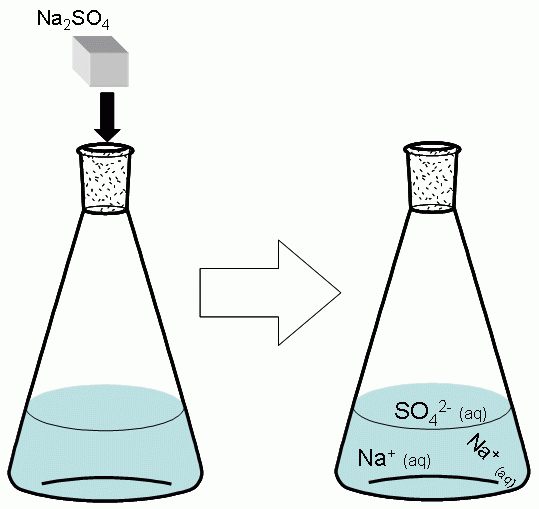
Взема се също воден разтвор на бариев хлорид - BaCl 2 , чиято молекула се дисоциира на три йона: един Ba 2+ и два Cl - ,
BaCl 2 → Ba 2+ + 2Cl -
Смесва се воден разтвор на сулфат и смес, съдържаща хлорид. Бариевият сулфат се образува в резултат на комбиниране в една молекула на два йона със същата по величина и противоположност зареден знак.
Ва 2+ + SO 4 2- → BaSO 4
По-долу можете да видите пълното уравнение на тази реакция (така наречената молекулна).
Na2S04 + BaCl2 → 2NaCl + BaSO4 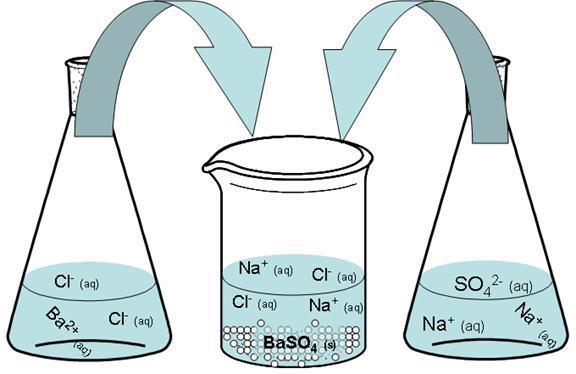
Резултатът е неразтворима утайка от бариев сулфат.
Стоки Барит
На практика, суровината за получаване на търговски бариев сулфат, предназначена за използване в сондажни флуиди за пробиване на нефтени и газови кладенци, е по правило минерален барит.
Терминът "първичен" барит се отнася до продукти на пазара, които включват суровина (получена от мини и кариери), както и прости продукти за обогатяване чрез методи като измиване, утаяване, разделяне в тежки среди, флотация. По-голямата част от суровия барит изисква довеждането му до минимална чистота и плътност. Минералът, който се използва като пълнител, се раздробява и пресява до еднакъв размер, така че поне 97% от неговите частици имат размер до 75 микрона и не повече от 30% са по-малки от 6 микрона. Първичният барит също трябва да бъде достатъчно гъст, така че неговото специфично тегло да е 4.2 g / cm 3 или по-високо, но в същото време достатъчно меко, за да не се повредят лагерите.
Приготвяне на химически чист продукт
Минералният барит често е замърсен с различни примеси, главно железни оксиди, които го оцветяват в различни цветове. Преработва се по карботермичен метод (нагряване с кокс). Резултатът е бариев сулфид.
BaSO 4 + 4 С → BaS + 4 СО
Последният, за разлика от сулфата, е разтворим във вода и лесно реагира с кислород, халогени и киселини.
BaS + H2SO4 → BaS04 + H2S
За да се получи продукт с висока чистота, използвайте сярна киселина. Бариевият сулфат, образуван от този процес, често се нарича бланфикс, който на френски означава "фиксиран бял". Често се среща в потребителски продукти като бои.

В лабораторни условия бариевият сулфат се образува чрез смесване на бариеви йони и сулфатни йони в разтвора (виж по-горе). Тъй като сулфатът е най-малко токсичната бариева сол поради неговата неразтворимост, отпадъците, съдържащи неговите други соли, понякога се третират натриев сулфат да свържем целия барий, който е доста токсичен.
От сулфат до хидроксид и обратно
Исторически, барит се използва за производство на бариев хидроксид Ba (OH) 2 , който е необходим за рафиниране на захар. Обикновено това е много интересно и широко използвано съединение в индустрията. Той е лесно разтворим във вода, образува разтвор, известен като баритова вода. Удобно е да се използват за свързване на сулфатни йони в различни състави чрез образуването на неразтворим BaSO4.
Видяхме по-горе, че при нагряване в присъствието на кокс от сулфат е лесно да се получи водоразтворим бариев сулфид - BaS. Последният, в контакт с гореща вода, образува хидроксид.
BaS + 2H2O → Ba (OH) 2 + H2S
Бариев хидроксид и натриев сулфат, взети в разтвор, когато са смесени, ще дадат неразтворима утайка от бариев сулфат и каустик натрий.
Ва (ОН) 2 + Na2S04 = BaS04 + 2NaOH

Оказва се, че природният бариев сулфат (барит) първо се превръща в бариев хидроксид чрез промишлени методи и след това служи за получаване на същия сулфат при почистване на различни солни системи от сулфатни йони. По същия начин реакцията ще се осъществи при почистване от SO 4 йони - разтвор на меден сулфат. Ако направите смес от бариев хидроксид + меден сулфат, тогава резултатът е меден хидроксид и неразтворим бариев сулфат.
CuS04 + Ba (OH) 2 → Cu (OH) 2 + BaSO4 '
Дори в реакцията със самата сярна киселина, нейните сулфатни йони ще бъдат напълно свързани с барий.
Използва се в сондажна кал
Около 80% от световното производство на бариев сулфат, пречистен и смлян барит се консумира като компонент на сондажни течности при създаването на петролни и газови кладенци. Добавянето му увеличава плътността на течността, инжектирана в кладенеца, с цел по-добра устойчивост на високо формово налягане и предотвратяване на пробиви.
Когато кладенецът бъде пробит, битът преминава през различна формация, всяка от които има свои характеристики. Колкото по-голяма е дълбочината, толкова по-голям е процентът на барита в структурата на разтвора. Допълнително предимство е, че бариевият сулфат е немагнитно вещество, така че той не пречи на различни измервания в кладенеца с електронни устройства.
Производство на бои и хартия
Повечето синтетични BaSO 4 се използват като компонент на бял пигмент за бои. По този начин бланкът, фиксиран в смес с титанов диоксид (TiO 2 ), се продава като бяла маслена боя, използвана при боядисване.
Комбинацията от BaSO 4 и ZnS (цинков сулфид) произвежда неорганичен пигмент, наречен литопон. Използва се като покритие за определени видове фотографска хартия.
Напоследък бариевият сулфат е бил използван за осветяване на хартия, предназначена за мастилено-струйни принтери.
Приложение в химическата промишленост и цветната металургия
При производството на полипропилен и полистирол BaSO 4 Използва се като пълнител в съотношение до 70%. Той има ефект на повишаване на устойчивостта на пластмасите към киселини и основи, а също така им придава непрозрачност.
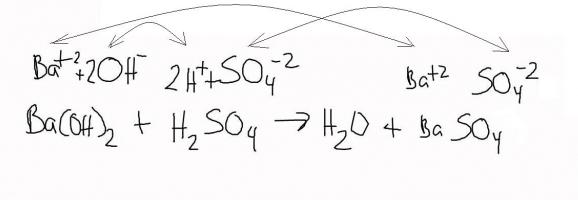
Той се използва и за производството на други бариеви съединения, по-специално на неговия карбонат, който се използва за производството на LED стъкло за телевизионни и компютърни екрани (исторически в електроннолъчеви тръби).
Формите, използвани в леенето на метали, често покриват бария със сулфат, за да се предотврати адхезия към стопения метал. Това се прави при производството на анодни медни плочи. Те се изливат в медни форми, покрити със слой бариев сулфат. Когато течната мед се втвърдява като завършена анодна плоча, тя може лесно да се отстрани от матрицата.
Пиротехнически устройства
Тъй като бариевите съединения излъчват зелена светлина при изгаряне, солите на това вещество често използват пиротехнически формули. Въпреки че нитратите и хлоратите са по-често срещани от сулфатните, последният се използва широко като компонент на пиротехническите стробоскопи.
Радиоконтрастни медикаменти
Бариевият сулфат е рентгеноконтрастен агент, използван за диагностициране на някои медицински проблеми. Тъй като такива вещества са непрозрачни рентгенови лъчи (блокирайте ги в резултат на тяхната висока плътност), тогава областите на тялото, в които те са локализирани, се появяват като бели петна върху рентгеновия филм. Това създава необходимото разграничение между един (диагностициращ) орган и други (около него) тъкани. Контрастът ще помогне на лекаря да види някакви специални условия, които могат да съществуват в този орган или част от тялото.

Бариевият сулфат се приема през устата или ректално с клизма. В първия случай той прави непрозрачен за рентгеновите лъчи хранопровода, стомаха или тънките черва. Така те могат да бъдат снимани. Ако веществото се прилага с помощта на клизма, тогава дебелото черво или червата могат да се видят и фиксират с рентгенови лъчи.
Дозата на бариевия сулфат ще бъде различна за различните пациенти, всичко зависи от вида на теста. Лекарството се предлага под формата на специална медицинска бариева суспензия или таблетки. Различни тестове, които изискват контрастно и рентгеново оборудване, изискват различни количества от суспензията (в някои случаи е необходимо лекарството да се приема в таблетна форма). Контрастът трябва да се използва само под прякото наблюдение на лекар.