Функцията и структурата на протеина
Протеините са органични високомолекулни съединения. Тези вещества се наричат също протеини, полипептиди. След това разгледайте структурата и функцията на протеините.
Обща информация
Химичната структура на протеините е представена от алфа-аминокиселини, свързани във верига чрез пептидна връзка. В живите организми съставът определя генетичния код. В процеса на синтез в повечето случаи се използват 20 стандартни аминокиселини. Много от техните комбинации образуват протеинови молекули с голямо разнообразие от свойства. Аминокиселинните остатъци често се подлагат на пост-транслационни модификации. Те могат да се появят преди протеинът да започне да изпълнява функциите си и в процеса на своята дейност в клетката. В живите организми често няколко молекули образуват сложни комплекси. Пример за това е фотосинтетичната асоциация.
Задаване на връзка
Протеините се считат за важен компонент на храненето на хора и животни, поради факта, че в техните организми не могат да бъдат синтезирани всички необходими аминокиселини. Някои от тях трябва да дойдат заедно протеинова храна. Основните източници на съединения са месо, ядки, мляко, риба, зърнени храни. В по-малка степен протеините присъстват в зеленчуците, гъбите и плодовете. По време на храносмилането от ензими, консумираните протеини се разрушават до аминокиселини. Те вече се използват в биосинтеза на собствените си протеини в тялото или се подлагат на по-нататъшно разпадане - за енергия.
Исторически фон
Последователността на структурата на инсулиновия протеин е определена за първи път от Frederius Senger. За своята работа е получил Нобелова награда през 1958 година. Sanger използва метода на секвениране. Използване на дифракция рентгеново лъчение впоследствие бяха получени триизмерни структури на миоглобина и хемоглобина (в края на 50-те години). Работата е извършена от Джон Кендрю и Макс Перуц.
Структура на протеинова молекула
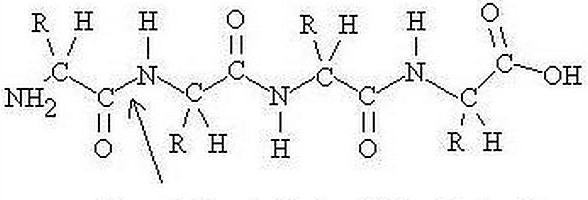
Тя включва линейни полимери. Те от своя страна са съставени от алфа-аминокиселинни остатъци, които са мономери. В допълнение, протеиновата структура може да включва компоненти, които имат не-аминокиселинна природа, и аминокиселинни остатъци от модифициран тип. В обозначението на компонентите се използват 1- или 3-буквени съкращения. Съединение, което съдържа от два до няколко десетки остатъка, често се нарича "полипептид". В резултат на взаимодействието на алфа-карбоксилната група на една аминокиселина с алфа-аминогрупата на другата се появяват връзки (по време на образуването на протеиновата структура). В съединението, С- и N-краищата са изолирани, в зависимост от това коя група аминокиселинен остатък е свободен: -СООН или -NH2. В ход синтез на протеини на рибозомата като първи терминал, като правило, метионинов остатък действа; присъединяването на следващия се извършва до края на предходните
Нива на организация
Те бяха предложени от Lindrem-Lang. Въпреки че това разделение се счита за малко остаряло, то все още се използва. Беше предложено да се разграничат четири нива на организация на връзката. Първичната структура на протеиновата молекула се определя от генетичния код и характеристиките на гена. За по-високи нива е характерно образуването по време на сгъстяването на протеините. Пространствената структура на протеина се определя в цялата аминокиселинна верига. Въпреки това, той е доста лабилен. Тя може да бъде повлияна от външни фактори. В това отношение е по-правилно да се говори за конформацията на съединението, най-полезната и предпочитана енергия.
Ниво 1
Той е представен от последователност от аминокиселинни остатъци на полипептидната верига. По правило се описва с едно-или трибуквени обозначения. Първичната структура на протеините се характеризира със стабилни комбинации от аминокиселинни остатъци. Те изпълняват определени задачи. Такива "консервативни мотиви" остават запазени в хода на еволюцията на видовете. Според тях, доста често можете да предскажете проблема с неизвестен протеин. Чрез оценка на степента на сходство (хомология) в аминокиселинните вериги от различни организми, може да се определи еволюционното разстояние, формирано между таксоните, които съставляват тези организми. Първичната структура на протеините се определя чрез секвениране или от първоначалния комплекс на неговата иРНК, като се използва таблицата на генетичния код.
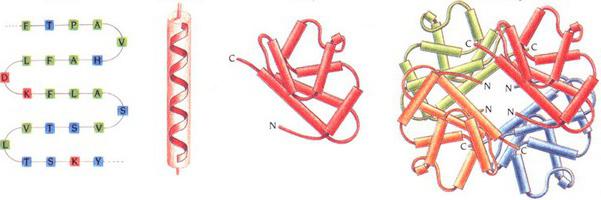
Локално подреждане на секцията на веригата
Това е следващото ниво на организация - вторичната структура на протеините. Има няколко вида. Местното подреждане на верижен участък на полипептид се стабилизира чрез водородни връзки. Най-популярните видове са:
- Алфа спирала Те са представени под формата на плътни намотки около дългата молекулна ос. Един ход е съставен от 3.6 аминокиселинни остатъка. Степента на спирала е 0.54 nm. Тази вторична протеинова структура се стабилизира чрез взаимодействията на Н- и О-пептидните групи, които са 4 единици една след друга. Алфа спиралата може да бъде лява или дясна ръка. Последното обаче най-често се открива в протеиновите съединения. Електростатични взаимодействия на аргинин, лизин, глутаминова киселина. В непосредствена близост, остатъци от левцин, треонин, серин и аспарагин могат да предизвикат стерично взаимодействие с образуването. Нарушаването на алфа-спиралата (нейното огъване) се причинява от части от пролина.
- Бета списъци. Те са представени под формата на няколко зигзагообразни полипептидни вериги. В тях се образуват водородни връзки между аминокиселини, относително отдалечени в първичната структура, или различни протеинови вериги. Връзките обикновено са ориентирани N-краища в противоположна посока (антипаралелна ориентация). При образуването на бета-списъци, малкият размер на страничните групи аминокиселини е важен.
- Неподредени фрагменти.
- 310- и π-спирала и други.

Пространствена структура
Третичната структура на протеините включва елементи от предишното ниво. Те се стабилизират чрез различни видове взаимодействия. Хидрофобните връзки са от най-голямо значение. В стабилизацията участват:
- Ковалентни взаимодействия.
- Йонни връзки, които се образуват между странични аминокиселинни групи, които имат противоположни заряди.
- Водородни взаимодействия.
- Хидрофобни връзки. В процеса на взаимодействие с околните Н2О елементи, нагъването на протеини става така, че страничните неполярни аминокиселинни групи се изолират от водния разтвор. На повърхността на молекулата се появяват хидрофилни групи (полярни).
Третичната структура на протеините се определя чрез магнитни (ядрени) резонансни методи, някои видове микроскопия и други методи.
Принцип на полагане
Проучванията показват, че между 2 и 3 нива е удобно да се разпредели друг. Тя се нарича "архитектура", "мотив за стил". Тя се определя от относителното положение на компонентите на вторичната структура (бета нишки и алфа спирали) в границите на компактната глобула, протеиновия домен. Той може да съществува независимо или да бъде включен в състава на по-голям протеин заедно с други подобни. Установено е, че стилизиращите мотиви са доста консервативни. Те се намират в протеини, които нямат нито еволюционни, нито функционални връзки. Определението за архитектура е в основата на рационалната (физическа) класификация.
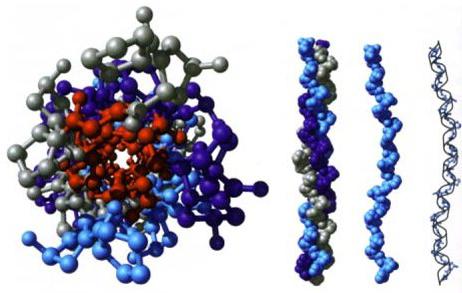
Организация на домейн
С взаимното подреждане на няколко полипептидни вериги в рамките на един протеинов комплекс се образува кватернерна протеинова структура. Елементите, включени в състава му, се образуват отделно върху рибозомите. Едва в края на синтеза започва да се формира тази протеинова структура. Той може да съдържа както различни, така и идентични полипептидни вериги. Четвъртичната структура на протеините се стабилизира поради същите взаимодействия както при предишното ниво. Някои комплекси могат да включват няколко десетки протеини.
Структура на протеините: Защитни цели
Полипептидите на цитоскелета, действащи по някакъв начин като арматура, придават форма на много органоиди и участват в неговата промяна. Структурните протеини осигуряват защита за тялото. Например, този протеин е колаген. Той е в основата на междуклетъчното вещество на съединителните тъкани. Кератин също има защитна функция. Той формира основата на рога, пера, коса и други производни на епидермиса. Когато протеинът свързва токсините в много случаи, се наблюдава детоксикация на последното. Това е задача на химическата защита на тялото. Особено важна роля в процеса на неутрализиране на токсините в човешкото тяло играят чернодробните ензими. Те могат да разделят отрови или да ги превърнат в разтворима форма. Това допринася за по-бързото транспортиране от тялото. Протеините, присъстващи в кръвта и други биологични течности, осигуряват имунна защита, причинявайки реакция както на атака на патогени, така и на увреждане. Имуноглобулините (антитела и компоненти на комплементната система) са способни да неутрализират бактерии, чужди протеини и вируси.
Регулаторен механизъм
Протеиновите молекули, които не действат нито като източник на енергия, нито като строителен материал, контролират много вътреклетъчни процеси. Така, благодарение на тях, се извършва регулиране на транслацията, транскрипция, нарязване, активност на други полипептиди. Механизмът на регулиране се основава на ензимна активност или се проявява поради специфично свързване с други молекули. Например, транскрипционни фактори, активаторни полипептиди и репресорни протеини са в състояние да контролират интензивността на генната транскрипция. В същото време те взаимодействат с регулаторни последователности на гените. Най-важната роля в контролирането на хода на вътреклетъчните процеси е свързана с протеинови фосфатази и протеин кинази. Тези ензими задействат или инхибират активността на други протеини чрез добавяне или разцепване на фосфатни групи от тях.
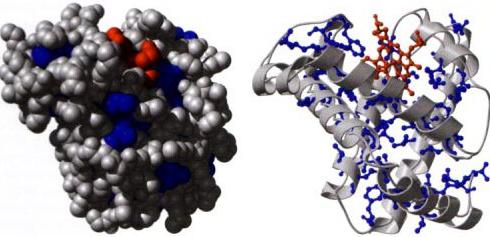
Задача за сигнализация
Често се комбинира с регулаторна функция. Това се дължи на факта, че много вътреклетъчни, както и извънклетъчни, полипептиди могат да предават сигнали. Растежни фактори, цитокини, хормони и други съединения имат тази способност. Стероидите се транспортират чрез кръв. Взаимодействието на хормоните с рецептора действа като сигнал, поради което се предизвиква реакцията на клетката. Стероидите контролират съдържанието на съединенията в кръвта и клетките, репродукцията, растежа и други процеси. Пример за това е инсулин. Регулира нивото на глюкозата. Взаимодействието на клетките се осъществява чрез сигнализиране на протеинови съединения, предавани чрез междуклетъчното вещество.
Транспортиране на елементи
Разтворимите протеини, участващи в движението на малки молекули, имат висок афинитет към субстрата, присъстващ в повишени концентрации. Те също така имат възможност лесно да я освобождават в области с ниско съдържание. Пример за това е транспортният протеин хемоглобин. Премества кислорода от белите дробове в други тъкани, а от тях - прехвърля въглероден диоксид. Някои мембранни протеини също участват в транспортирането на малки молекули през клетъчните стени, като ги променят. Цитоплазменият липиден слой е водоустойчив. Това предотвратява дифузията на заредени или полярни молекули. Мембранните транспортни връзки могат да бъдат разделени на носители и канали.
Резервни връзки
Тези протеини образуват така наречените резерви. Те се натрупват, например, в семената на растенията, животинските яйца. Такива протеини действат като резервен източник на материя и енергия. Някои съединения се използват от тялото като аминокиселинен резервоар. Те от своя страна са прекурсори на активни вещества, участващи в регулирането на метаболизма.
Клетъчни рецептори
Такива протеини могат да бъдат разположени или директно в цитоплазмата, или вградени в стената. Една част от връзката получава сигнал. Като правило, това е обикновено химическо вещество, а в някои случаи - механично действие (разтягане, например), светлина и други стимули. В процеса на излагане на сигнал на специфичен фрагмент от молекула - полипептиден рецептор - започват неговите конформационни промени. Те провокират промяна в конформацията на останалата част, която прехвърля стимула към другите компоненти на клетката. Изпращането на сигнал може да се извърши по различни начини. Някои рецептори са способни да катализират химична реакция, докато последните действат като йонни канали, затварящи или отварящи се под въздействието на стимул. Някои съединения специфично свързват медииращи молекули в клетката.
Моторни полипептиди
Има цял клас протеини, които осигуряват движение на тялото. Моторните протеини участват в мускулната контракция, движението на клетките, активността на флагела и ресничките. Благодарение на тях се извършва и насочен и активен транспорт. Кинезините и диенините прехвърлят молекули по микротубулите, използвайки АТФ като енергиен източник на хидролиза. Последните преместват органоидите и другите елементи към центрозома от периферните клетъчни места. Кинезините се движат в обратна посока. Dyneiny, освен това, са отговорни за дейността на флагела и ресничките.