Въглеродният атом: структура, характеристики и свойства
В тази статия разглеждаме елемент, който е част от периодичната таблица D.I. Менделеев, а именно въглерод. В съвременната номенклатура, тя е обозначена със символа С, е в четиринадесета група и е "участник" на втория период, има шести пореден номер и неговата аму. = 12.0107.
Атомни орбитали и тяхната хибридизация
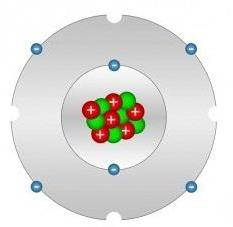
Нека започнем да разглеждаме въглерода от неговите орбитали и тяхната хибридизация - нейните основни характеристики, благодарение на които все още се удивляват учените от целия свят. Каква е тяхната структура?
Хибридизацията на въглеродния атом е подредена по такъв начин, че валентните електрони заемат позиции на три орбитали, а именно: едната е на 2s орбиталите, а две е на 2p-орбитали. Последните две от трите орбитали образуват ъгъл, равен на 90 градуса един спрямо друг, а орбитата 2s има сферична симетрия. Въпреки това, тази форма на устройството на разглежданите орбитали не ни позволява да разберем защо въглеродът навлиза органични съединения образува ъгли от 120, 180 и 109.5 градуса. Формулата за електронната структура на въглеродния атом се изразява по следния начин: (He) 2s 2 2p 2 .
Разрешаването на полученото противоречие е направено чрез въвеждане на концепцията за хибридизация на атомни орбитали. За да се разбере триедричната, вариативната природа на С, е необходимо да се създадат три форми на разбиране на неговата хибридизация. Основният принос за възникването и развитието на тази концепция е направен от Линус Полинг.
Физични свойства
Структурата на въглеродния атом определя наличието на редица особености на физическата природа. Атомите на този елемент образуват просто вещество - въглерод, който има модификации. Вариациите в промените в структурата му могат да дадат на образуваното вещество различни качествени характеристики. Причината за наличието на голям брой въглеродни модификации се крие в способността му да установява и образува хетерогенни връзки с химическа природа.
Структурата на въглеродния атом може да варира, което му позволява да има определен брой изотопни форми. Откритият в природата въглерод се образува с помощта на два изотопа в стабилно състояние - 12 C и 13 C - и изотоп с радиоактивни свойства - 14 C. Последният изотоп е концентриран в горните слоеве на земната кора и в атмосферата. Поради влиянието на космическата радиация, а именно нейните неутрони, върху ядрото на азотните атоми, радиоактивен изотоп от 14 ° С. водородна бомба. Именно върху процеса на разпадане на 14С се основава методът на радиовъглеродното датиране, който намира широко приложение в археологията и геологията.
Модификация на въглерода в алотропна форма
В природата има много вещества, които съдържат въглерод. Човек използва структурата на въглеродния атом за своите собствени цели, когато създава различни вещества, включително:
- Кристални въглени (диаманти, въглеродни нанотръби, влакна и жици, фулерени и др.).
- Аморфни въглени (активирани и активни въглища, различни видове кокс, сажди, сажди, нанопями и антрацити).
- Клъстерни форми на въглерод (ди-въглерод, нанокони и астраленови съединения).
Структурни особености на атомната структура
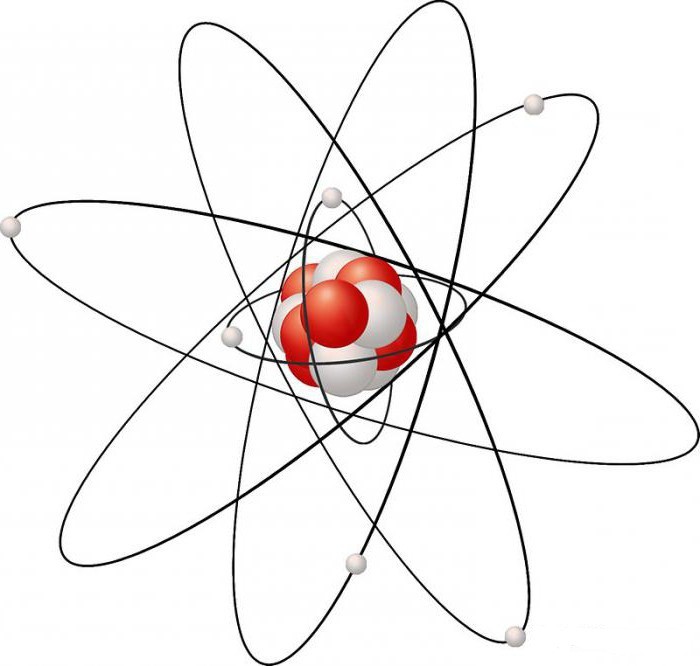
Електронната структура на въглеродния атом може да има различна геометрия, която зависи от нивото на хибридизация на орбиталите, с които разполага. Има 3 основни вида геометрия:
- Tetrahedral - създава се поради изместване на четири електрона, един от които е s-, а три принадлежат на p-електрони. Атом С заема централно място в тетраедъра и е свързан с четири еквивалентни сигма връзки с други атоми, заемащи върха на този тетраедър. При такова геометрично подреждане на въглерода, неговите алотропни форми могат да образуват, например, диамант и Лонсдейлит.
- Trigonal - дължи своя вид на изместване на три орбитали, от които един е s- и два p-. Тук има три сигма връзки, които са в еднакво положение помежду си; те лежат в обща равнина и се придържат към ъгъл от 120 градуса един спрямо друг. Свободната р-орбитала е разположена перпендикулярно на равнината на сигма-връзката. Графитът има подобна геометрия.
- Диагонал - появява се поради смесването на s-и p-електрони (sp хибридизация). Електронните облаци се изтеглят по общата посока и приемат формата на асиметрична гира. Свободните електрони създават π-връзки. Тази структура на геометрията в въглерода води до появата на карбин, специална форма на модификация.
Въглеродни атоми в природата
Структурата и свойствата на въглеродния атом отдавна се разглеждат от човека и се използват за получаване на голям брой различни вещества. Атомите на този елемент, поради тяхната уникална способност да образуват различни химически връзки и наличието на хибридизация на орбитали, създават много различни алотропни модификации с участието на само един елемент, от атоми от един и същи тип, въглерод.

В природата въглеродът се намира в земната кора; Той е под формата на диаманти, графити, различни горими природни богатства, например масло, антрацит, кафяви въглища, шисти, торф и др. Включени в газовете, използвани от човека в енергийната индустрия. Въглеродът в състава на своя диоксид запълва хидросферата и атмосферата на Земята, а във въздуха достига 0.046%, а във водата - до шестдесет пъти повече.
В човешкото тяло С се съдържа в количество, приблизително равно на 21%, и се екскретира главно в урината и издишания въздух. Същият елемент е включен в биологичния цикъл, той се абсорбира от растенията и се консумира по време на фотосинтезата.
Въглеродните атоми, поради способността им да създават различни ковалентни връзки и да изграждат вериги от тях и дори цикли, могат да създадат огромно количество вещества от органична природа. В допълнение, този елемент е част от слънчевата атмосфера, намира се в съединения с водород и азот.
Химични свойства

Сега разгледайте структурата и свойствата на въглеродния атом от химическа гледна точка.
Важно е да се знае, че въглеродът проявява инертни свойства при нормални температурни условия, но може да ни покаже свойствата на редуцираща природа под въздействието на високи температури. основен окислителни състояния: + - 4, понякога +2, а също и +3.
Участва в реакцията с голям брой елементи. Може да реагира с вода, водород, халогени, алкални метали киселини, флуор, сяра и др.
Структурата на въглеродния атом генерира огромно количество вещества, разделени в отделен клас. Такива съединения се наричат органични и се основават на C. Възможно е поради свойствата на атомите на този елемент да се образуват полимерни вериги. Сред най-известните и екстензивни групи са протеини (протеини), мазнини, въглехидрати и въглеводородни съединения.
Методи за работа
Поради уникалната структура на въглеродния атом и съпътстващите го свойства, елементът е широко използван от хората, например, когато се създават моливи, тук се използват метални тигели за топене - графит. Диамантите се използват като абразивни материали, бижута, дюзи за бормашини и др.
Фармакологията и медицината също участват в използването на въглерод в различни съединения. Този елемент е част от стоманата, служи като основа за всеки органична материя участва в процеса на фотосинтеза и др.
Токсичност на елементите

Структурата на въглеродния атом съдържа наличието на опасен ефект върху живата материя. Въглеродът навлиза в света около нас в резултат на изгарянето на въглища в топлоелектрическите централи, част от газовете, произвеждани от автомобили, в случая на въглищен концентрат и др.
Високият процент въглерод в аерозолите, което води до увеличаване на честотата на хората. Най-често са засегнати горните дихателни пътища и белите дробове. Някои заболявания могат да бъдат класифицирани като професионални, например, прахов бронхит и заболявания на групата на пневмокониоза.
14 C е токсичен и силата на неговото влияние се определя от радиационното взаимодействие с β-частици. Този атом е част от състава на биологичните молекули, включително тези, съдържащи се в дезокси и рибонуклеиновите киселини. Допустимото количество от 14 C във въздуха на работната зона се счита за 1,3 Bq / l. Максималното количество въглерод, постъпващо в тялото по време на дишането, е равно на 3,2 * 10 8 Bq / година.