Кислород: химични свойства на елемента
Един от най-важните елементи на нашата планета е кислородът. Химичните свойства на това вещество му позволяват да участва в биологични процеси, а повишената активност прави кислорода важен участник във всички известни химични реакции. В свободното състояние това вещество присъства в атмосферата. В обвързаното състояние, кислородът е включен в състава на минералите, скалите, сложните вещества, които съставляват различни живи организми. Общото количество кислород на Земята се оценява на 47% от общата маса на нашата планета.
Обозначение на кислорода
В периодичната система кислородът заема осмата клетка на тази таблица. Международното му име е оксигений. В химически записи се обозначава с латинската буква "О". В естествената среда атомният кислород не се среща, частиците му се съчетават, за да образуват двойка газови молекули, чиято молекулна маса е 32 g / mol.
Въздух и кислород
Въздухът е смес от няколко газове, обичайни за Земята. Най-много във въздушната маса на азота - 78.2% обемни и 75.5% тегловни. Кислородът заема само второ място по обем - 20.9%, а по тегло - 23.2%. Третото място е определено за благородните газове. Останалите примеси - въглероден диоксид, водна пара, прах и т.н. - заемат само част от процента от общата въздушна маса. 
Цялата маса на естествения кислород е смес от три изотопа - 16 O, 17 O, 18 O. Процентът на тези изотопи в общата маса на кислорода е 99,76%, 0,04% и 0,2%, съответно.
Физични и химични свойства на кислорода
Един литър въздух тежи 1,293 g при нормални условия, а когато температурата падне до -140 ° C, въздухът става безцветна прозрачна течност. Въпреки ниската точка на кипене, въздухът може да се поддържа в течно състояние дори при стайна температура. За да направите това, течността трябва да се постави в т.нар Съд на Дюар. Потапянето в течен кислород фундаментално променя обичайните свойства на обектите.  Етилов алкохол и много газове стават твърди предмети, живакът придобива твърдост и ковкост, а гумената топка губи своята еластичност и се разпада при най-малък удар.
Етилов алкохол и много газове стават твърди предмети, живакът придобива твърдост и ковкост, а гумената топка губи своята еластичност и се разпада при най-малък удар.
Кислородът е разтворим във вода, въпреки че в малки количества - морската вода съдържа 3-5% кислород. Но дори такова малко количество от този газ бележи началото на съществуването на риба, миди и различни морски организми, които получават кислород от водата, за да поддържат собствените си процеси на поддържане на живота.
Структурата на кислородния атом
Описаните свойства на кислорода се дължат предимно на вътрешната структура на този елемент. 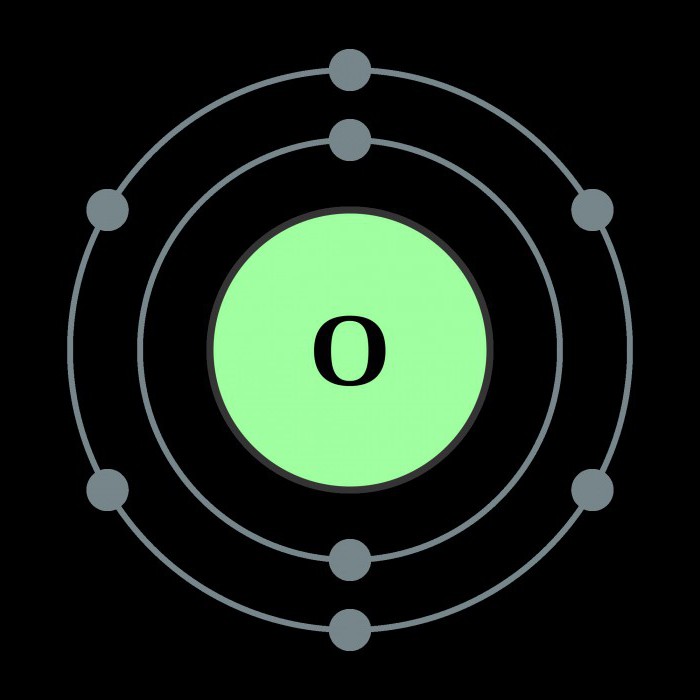
Кислородът принадлежи към основната подгрупа на шестата група от елементи на периодичната система. Във външния електронен облак на елемента има шест електрона, четири от които заемат р-орбитали, а останалите две са разположени на s-орбитали. Тази вътрешна структура причинява големи енергийни разходи, насочени към разрушаване на електронните връзки - за кислородния атом е по-лесно да заемат два липсващи електрона към външната орбита, отколкото да се откажат от шестте си. Следователно ковалентността на кислорода в повечето случаи е равна на две. Благодарение на два свободни електрона, кислородът лесно образува двуатомни молекули, които се характеризират с висока сила на свързване. Само при приложена енергия повече от 498 J / mol молекулите се дезинтегрират и се образува атомен кислород. Химичните свойства на този елемент му позволяват да реагира с всички известни вещества, с изключение на хелий, неон и аргон. Скоростта на взаимодействие зависи от температурата на реакцията и естеството на веществото. 
Химични свойства на кислорода
С различни вещества кислородът влиза в реакцията на образуване на оксиди и тези реакции са характерни за метали и неметали. Съединения на кислород с метали се наричат основни оксиди - магнезиев оксид и калциев оксид са класически пример. Взаимодействието на метални оксиди с вода води до образуването на хидроксиди, потвърждаващи активните химични свойства на кислорода. При неметалите това вещество образува кисели оксиди - например, серен триоксид SO 3. Когато този елемент взаимодейства с вода, се оказва сярна киселина.
Химическа активност
С огромното мнозинство от елементи кислородът взаимодейства директно. Изключение правят златото, халогените и платината. Взаимодействието на кислород с определени вещества се ускорява значително в присъствието на катализатори. Например, смес от водород и кислород в присъствието на платина реагира дори при стайна температура. При оглушителна експлозия сместа се превръща в обикновена вода, от която кислородът е важна част. Химичните свойства и високата активност на елемента обясняват отделянето на голямо количество светлина и топлина, така че химичните реакции с кислород често се наричат изгаряне. 
Горенето в чист кислород се осъществява много по-интензивно, отколкото във въздуха, въпреки че количеството на отделената по време на реакцията топлина ще бъде приблизително еднакво, но поради липсата на азот процесът протича много по-бързо и температурата на горене става по-висока.
Производство на кислород
През 1774 г. английският учен Д. Свещено освобождава неизвестен газ от реакция на разлагане на живачен оксид. Но ученият не свързва изпуснатия газ с вече познатото вещество, което влиза в него въздушен състав. Само няколко години по-късно великият Лавуазие изучава физикохимичните свойства на кислорода, получен в тази реакция, и доказа своята идентичност с газа, който образува въздуха. В съвременния свят кислородът се получава от въздуха. В лабораториите използвам промишлен кислород, който се доставя от бутилки под налягане от около 15 MPa. Чистият кислород може да се получи и в лабораторни условия, като стандартният метод за неговото производство е термичното разлагане на калиев перманганат, който протича по формулата:
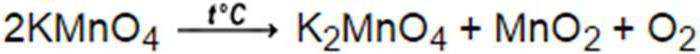
Производство на озон
Ако електричеството преминава през кислород или въздух, в атмосферата ще се появи характерен мирис, който предвещава появата на ново вещество - озон. Озонът може да се получи и от химически чист кислород. Образуването на това вещество може да се изрази по формулата:
30 2 = 20 3
Тази реакция не може да продължи самостоятелно - за успешното му завършване е необходима външна енергия. Но обратното превръщане на озона в кислород възниква спонтанно. Химичните свойства на кислорода и озона се различават значително. Озонът се различава от плътността на кислорода, точката на топене и точката на кипене. При нормални условия този газ е син и има характерен мирис. Озонът има по-висока електропроводимост и е по-разтворим във вода от кислорода. Химичните свойства на озона се обясняват с процеса на неговия разпад - при разлагането на молекулата на това вещество се образува двуатомна кислородна молекула плюс един свободен атом на този елемент, който реагира агресивно с други вещества. Например, известната реакция на взаимодействието на озон и кислород: 6Ag + O 3 = 3Ag 2 O
Но обикновеният кислород не се комбинира със сребро, дори и при високи температури. 
В природата, активният разпад на озона е изпълнен с образуването на т.нар озонови дупки които застрашават жизнените процеси на нашата планета.