Йонна връзка: примери за съединения
В резултат на взаимното електростатично привличане между молекулите и атомите на химичните елементи може да се получи йонна връзка. Примери за такива съединения могат да се наблюдават при различни реакции на галванични батерии, дори и прости сол има съединение от този тип. За това какво е йонна връзка Как се различава от ковалентното, описано в тази статия.
Прости и сложни йони
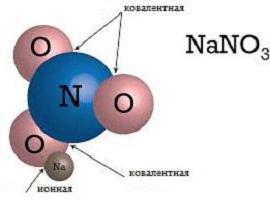
И двете отделни атоми и техните различни съединения участват в йонната връзка. Всички участници в такава връзка имат електрически заряд и задържани заедно поради електростатични сили. Има прости йони, като Na + , K + , които са катиони; F - , Cl - - свързани с аниони. Също така има сложни йони, състоящи се от два или повече атома. Примери за йонно химично свързване на базата на сложни йони са ОН-, аниони, NO3-, катион NH4 + . Простите йони с положителен заряд се формират от атоми с нисък йонизационен потенциал - обикновено те са метали от основните подгрупи от групи I - II. В повечето случаи простите йони с отрицателен заряд са типични неметали. 
Ковалентна и йонна връзка
Примери за системи, създадени от две частици с противоположни електрически заряди, показват, че в такъв случай винаги се появява електрическо поле. Това означава, че електрически активните йони могат също да привличат други йони в различни посоки. Поради силите на електрическо привличане и има йонна връзка. Примери за такива съединения показват две фундаментални разлики между йонните и ковалентните връзки.
- Електрическото поле на йона намалява с разстоянието във всяка посока. Следователно степента на взаимодействие между йони не зависи от това как тези йони се намират в пространството. От тези наблюдения можем да заключим, че йонната връзка е скаларна, т.е. тя няма насоченост.
- Два йона с различни заряди привличат не само един от друг, но и съседните заредени йони - различен брой заредени частици от противоположен знак могат да се присъединят към определен йон. Това е друга разлика между ковалентните и йонните връзки: последната не притежава наситеност. Броят на прикрепените йони се определя от линейните размери на заредените частици, както и от принципа, че атрактивните сили на йони с противоположни заряди трябва да имат предимство пред отблъскващите сили, които действат между еднакво заредени частици.
сдружаване
Тъй като липсва наситеност и насоченост на йони, те са склонни да се комбинират помежду си в различни комбинации. Тази собственост учени наричат асоциация. При високи температури асоциацията е малка: кинетична енергия молекули и йони са доста високи, а в газовото състояние веществата с йонна връзка са под формата на отделни молекули. Но средните и ниските температури правят възможно образуването на различни структурни съединения, образуването на които е отговорно за йонния тип връзка. На фигурите са показани примери за структурата на веществата в течно и твърдо състояние. 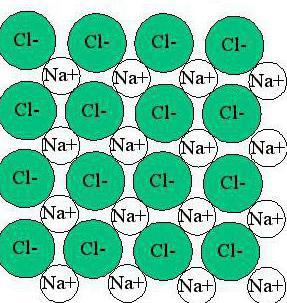
Както виждате, йонната връзка създава кристална решетка при което всеки елемент е заобиколен от йони с противоположен знак за зареждане. Освен това такова вещество има същите характеристики в различни посоки.
поляризация
Както знаете, когато един електрон е прикрепен към неметален атом, се освобождава определено количество енергия. Прикрепването на втория електрон вече изисква енергия, следователно образуването на прости многократно заредени аниони става енергийно неизгодно. Въпреки това, елементи като SO 4 2- , CO 2 2- показват, че сложни, многозаредени отрицателни йони могат да бъдат енергийно стабилни, тъй като електроните в съединението са разпределени по такъв начин, че зарядът на всеки атом не е по-голям от заряда на самия електрон. Тези правила са продиктувани от стандартната йонна връзка.
Примери за типични елементи, които се срещат на всеки етап (NaCl, CsF), не показват пълно разделяне на положителните и отрицателните заряди. Например, в кристал на сол, ефективният отрицателен заряд ще бъде само около 93% от общия заряд на електрона. Този ефект се наблюдава при други съединения. Това непълно зареждане се нарича поляризация. 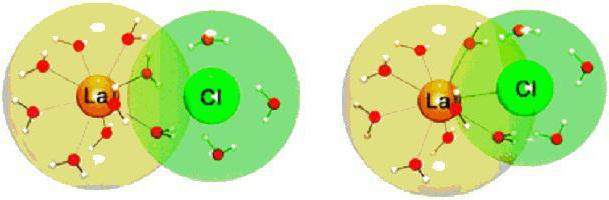
Причини за поляризация
Причината за поляризацията винаги е електрическо поле. Външният слой от електрони изпитва най-голямо изместване по време на поляризацията. Трябва да се отбележи обаче, че различните йони имат различна поляризуемост: колкото по-слабо е свързването на външния електрон с ядрото, толкова по-лесно се поляризира целият йон и колкото по-деформира се електронният облак.
Поляризацията на йони има известен ефект върху съединения, които образуват йонна връзка. Примери за химични реакции показват, че водородният йон Н + има най-голям поляризиращ ефект, тъй като има най-малък размер и пълно отсъствие на електронен облак.