Химично свързване - понятие и класификация
Всяко взаимодействие между атомите е възможно само ако има химическа връзка. Такава връзка е причината за образуването на стабилна многоатомна система - молекулен йон, молекула, кристална решетка. Една силна химическа връзка изисква много енергия, за да се счупи, така че това е основно количество за измерване на якостта на свързване.
Условия за химическо свързване
Образуването на химическа връзка винаги е съпроводено с освобождаване на енергия. Този процес се дължи на намаляването на потенциалната енергия на системата от взаимодействащи частици - молекули, йони, атоми. Потенциална енергия получената система от взаимодействащи елементи винаги е по-малка от енергията на несвързани изходящи частици. По този начин основата за появата на химическа връзка в системата е намаляването на потенциалната енергия на нейните елементи.
Същност на химичното взаимодействие
Химичното свързване е следствие от взаимодействието на електромагнитните полета, възникващи около електроните и атомните ядра на тези вещества, които участват в образуването на нова молекула или кристал. След откриването на теорията за структурата на атома, естеството на това взаимодействие става по-достъпно за изследване. 
За първи път в английския физик Г. Деви възникна идеята за електрическия характер на химичното свързване, който предположи, че молекулите се образуват поради електрическо привличане на противоположно заредени частици. Тази идея се интересуваше от шведския химик и натуралист И.Я. Berzelius, който разработи електрохимична теория за химическо свързване.
Първата теория, която обяснява процесите на химичното взаимодействие на веществата, е несъвършена и с времето тя трябва да бъде изоставена.
Теория на Бутлеров
По-успешен опит да се обясни естеството на химичната връзка на веществата е предприет от руския учен А.М.Бутлеров. В основата на неговата теория, този учен поставя такива предположения:
- Атомите в свързаното състояние са свързани помежду си в определен ред. Промяната в този ред е причината за образуването на нова субстанция.
- Атомите са обвързани с валентните закони.
- Свойствата на веществото зависят от реда на съединенията в молекулата на веществото. Различен ред на местоположението води до промяна в химичните свойства на веществото.
- Атомите, свързани помежду си, влияят взаимно най-силно.
Теорията на Бутлеров обяснява свойствата на химикалите не само от техния състав, но и от разположението на атомите. Такава вътрешна заповед на А.М. Бутлеров нарича "химическа структура". 
Теорията на руския учен позволява да се подредят нещата в класификацията на веществата и да се даде възможност да се определи структурата на молекулите според техните химически свойства. Теорията отговаря и на въпроса: защо молекулите, съдържащи същия брой атоми, имат различни химически свойства?
Предпоставки за създаване на теории за химически връзки
В своята теория за химическата структура Бутлеров не се е докосвал до въпроса какво представлява химическата връзка. За това имаше твърде малко данни за вътрешната структура на веществото. Само след отваряне планетарния модел на атома Американският учен Луис започнал да разработва хипотеза, че химическа връзка възниква чрез образуването на електронна двойка, която едновременно принадлежи на два атома. Впоследствие тази идея стана основа за развитието на теорията на ковалентните връзки.
Ковалентна химична връзка
Стабилно химическо съединение може да се образува, когато електронните облаци на два съседни атома се припокриват. Резултатът от това взаимно пресичане е увеличаващата се електронна плътност в междуядреното пространство. Ядрата на атомите, както е добре известно, са положително заредени и затова се опитват да се изтеглят възможно най-близо до отрицателно заредения електронен облак. Това привличане е много по-силно от отблъскващата сила между две положително заредени ядра, така че тази връзка е стабилна.
За първи път изчисленията на химичната връзка бяха извършени от химиците Гейтлер и Лондон. Те разглеждат връзката между два водородни атома. Най-простото визуално представяне на това може да изглежда така: 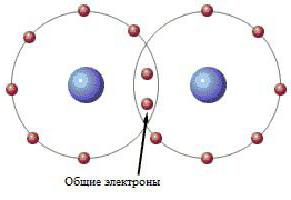
Както може да се види, електронната двойка заема квантово място и в двата водородни атома. Това двуцентрово разположение на електрони се нарича ковалентна химическа връзка. Ковалентна връзка типични за молекули на прости вещества и техните съединения от неметали. Вещества, създадени в резултат на ковалентно свързване, обикновено не провеждат електрически ток или са полупроводници.
Йонна връзка
Химична връзка на йонния тип възниква в случай на взаимно електрическо привличане на два противоположно заредени йона. Йони могат да бъдат прости, състоящи се от един атом от вещество. В съединения от този тип простите йони най-често са положително заредени метални атоми от група 1,2, които са загубили своя електрон. Образуването на отрицателни йони е присъщо на атомите на типичните неметали и основите на техните киселини. Следователно, сред типичните йонни съединения има много халиди алкални метали например CsF, NaCl и други. 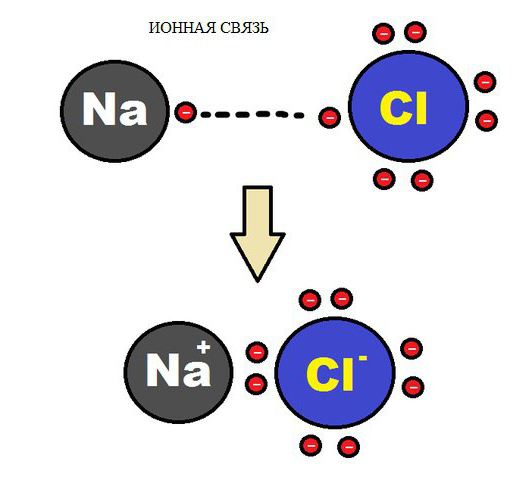
За разлика от ковалентната връзка, йонът не е наситен: различен брой противоположно заредени йони може да се присъедини към йон или група йони. Броят на прикрепените частици се ограничава само от линейните размери на взаимодействащите йони, както и от условията, при които силите на привличане на противоположно заредени йони трябва да бъдат по-големи от отблъскващите сили на еднакво заредени частици, участващи в йонно съединение.
Водородна връзка
Още преди създаването на теорията за химическата структура експериментално е наблюдавано, че водородните съединения с различни неметали притежават малко необичайни свойства. Например, точката на кипене на водородния флуорид и водата е много по-висока от очакваното. 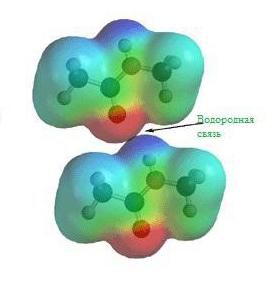
Тези и други характеристики на водородните съединения могат да се обяснят със способността на H + атома да образува друга химична връзка. Този тип съединение се нарича „водородна връзка“. Причините за водородната връзка се корени в свойствата на електростатичните сили. Например, в молекула водороден флуорид, обикновеният електронен облак е така изместен към флуор, че пространството около атома на това вещество е наситено с отрицателно електрическо поле. Около водородния атом, лишен от единствения си електрон, полето е много по-слабо и има положителен заряд. В резултат на това възниква допълнителна връзка между положителните полета на електронните облаци H + и отрицателните F - .
Химична връзка на метали
Атомите на всички метали се намират в пространството по определен начин. Подреждането на металните атоми се нарича кристална решетка. В този случай, електроните на различните атоми слабо си взаимодействат, образувайки общ електронен облак. Този тип взаимодействие между атоми и електрони се нарича "метална връзка". 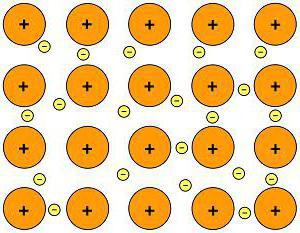 Това е свободното движение на електрони в метали, което може да обясни физичните свойства на металните вещества: електропроводимост, топлопроводимост, сила, разтопяемост и други.
Това е свободното движение на електрони в метали, което може да обясни физичните свойства на металните вещества: електропроводимост, топлопроводимост, сила, разтопяемост и други.