Физични и химични свойства на въглерода
Биологичният живот на Земята е представен от въглеродни съединения. Елементът е част от основните компоненти на клетъчните структури: протеини, въглехидрати и мазнини, и също така е в основата на същността на наследствеността - дезоксирибонуклеинова киселина. В неорганичната природа на въглерода е един от най-често срещаните елементи, които образуват земната кора и атмосферата на планетата. Органичната химия като част от химическата наука е напълно посветена на свойствата на химичния елемент въглерод и неговите съединения. Нашата статия ще разгледа физико-химичните характеристики на въглерода и характеристиките на неговите свойства.
Мястото на елемента в периодичната система
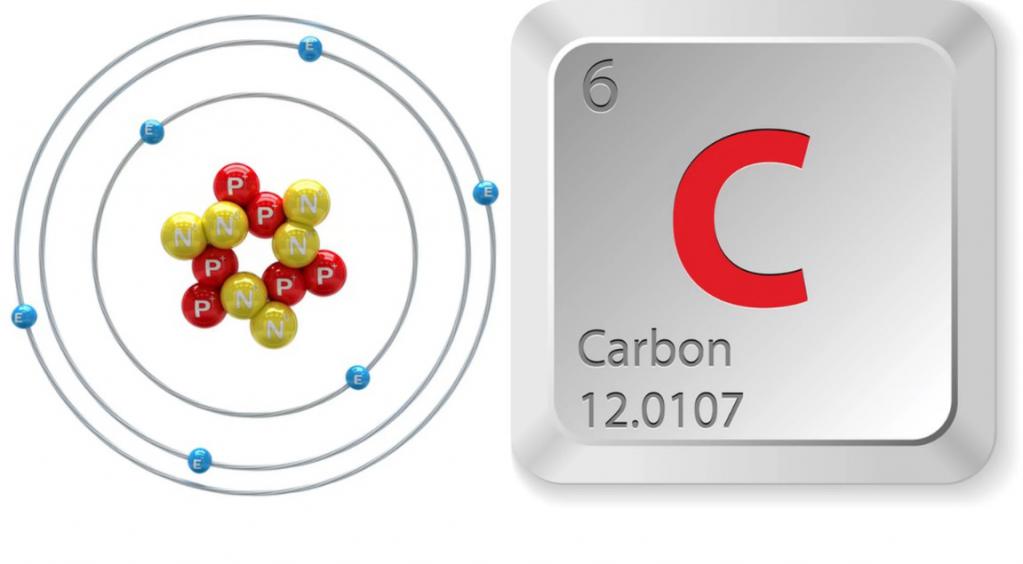
Въглеродната подгрупа е основната подгрупа от група IV, която в допълнение към въглерода включва също силиций, германий, калай и олово. Всички изброени елементи имат една и съща структура на външното енергийно ниво, на което са разположени четири електрона. Това води до сходство на техните химически свойства. В обичайното състояние, елементите на подгрупата са двувалентни, а когато техните атоми се възбуждат, те проявяват валентност, равна на 4. Физическите и химичните свойства на въглерода зависят от състоянието на електронните обвивки на нейния атом. По този начин, в реакция с кислород, елемент, чиито частици са в незаразено състояние, образува равномерен оксид CO. Въглеродните атоми в възбуденото състояние се окисляват до въглероден диоксид, който проявява киселинни свойства.

Въглеродни форми в природата
Диамант, графит и карбин са трите алотропни модификации на въглерода като проста субстанция. Прозрачни кристали с висока степен на пречупване на светлинни лъчи, които са най-трудните съединения в природата, са диаманти. Те водят топлина слабо и са диелектрици. Кристалната решетка е атомна, много издръжлива. В него всеки атом на елемент е заобиколен от четири други частици, образувайки правилен тетраедър.
Напълно различни физико-химични свойства на въглерода, който образува графит. Това е мазна, тъмно сива кристална субстанция. Тя има слоеста структура, разстоянията между слоевете на атомите са доста големи, докато силите им на привличане са слаби. Следователно, когато се натисне върху графитна пръчка, веществото се разделя на тънки люспи. Те оставят тъмен знак върху хартията. Графитът е проводим и малко по-малък от металите в електрическата проводимост.
Способността за провеждане на електрически ток се обяснява със структурата на кристалното вещество. В него въглеродните частици се свързват с другите три чрез силни ковалентни химически връзки. Четвъртият валентен електрон от всеки атом остава свободен и може да се движи в дебелината на веществото. Посоченото движение на отрицателно заредени частици и причинява появата на електрически ток. Графитните приложения са разнообразни. Така се използва за производството на електроди в електротехниката и за осъществяване на процеса на електролиза, с помощта на който те получават, например, алкални метали в чиста форма. Графитът е намерил приложение в ядрени реактори да контролира скоростта на верижните реакции, протичащи в тях като неутронни модератори. Известно е, че веществото се използва като шистов прът или лубрикант в триещите се части на механизмите.
Какво е карбин?
Черният кристален прах със стъклен блясък е карбин. Синтезира се в средата на 20 век в Русия. Веществото превъзхожда по твърдост по графит, химически пасивно, притежава свойствата на полупроводник и е най-стабилната модификация на въглерода. Съединението е по-трайно от графита. Има и форми на въглерод, чиито химични свойства се различават един от друг. Това са сажди, въглен и кокс.
Различните характеристики на въглеродните алотропни модификации се обясняват със структурата на техните кристални решетки. Това е огнеупорно вещество без цвят или мирис. Той е неразтворим в органични разтворители, но може да образува твърди разтвори - сплави, например, с желязо.
Химични свойства на въглерода
В зависимост от веществото, с което въглеродът реагира, той може да проявява двойни свойства: както редуктор, така и окислител. Например, сливане на кокс с метали, получаване на техните съединения - карбиди. В реакцията се образуват въглеводороди с водород. Това е така органични съединения например метан, етилен, ацетилен, в които, както в случая с металите, има въглерод окислително състояние равно на -4. Намаляващите химични реакции на въглерода, свойствата на които изучаваме, се проявяват при неговото взаимодействие с кислород, халогени, вода и основни оксиди.
Въглеродни оксиди
Изгарянето на въглища при въздух с нисък кислород произвежда въглероден оксид, двувалентен въглероден диоксид. Той е безцветен, без мирис и силно токсичен. Комбиниран с кръвен хемоглобин по време на дишането, въглеродният оксид се разпространява в човешкото тяло, причинявайки отравяне и след това смърт от задушаване. В класификацията веществото заема мястото на неразтворими оксиди, не реагира с водата, нито базата, нито киселината съответстват на нея. Химичните свойства на въглерода с валентност 4 се различават от предишната характеристика.
Въглероден диоксид
Безцветно газообразно вещество при температура 15 ° С и налягане на една атмосфера се превръща в твърда фаза. Нарича се сух лед. Молекулите на СО 2 са неполярни, въпреки че ковалентната връзка между кислородните атоми и въглерода е полярна. Свързването се отнася до кисели оксиди. Взаимодействайки с вода, той образува карбонатна киселина. Има реакции между въглеродния диоксид и простите вещества: метали и неметали, например, с магнезий, калций или кокс. В тях той играе ролята на окислител.
Качествена реакция към въглероден диоксид
За да се гарантира, че газът за изпитване е действително въглероден окис CO 2 , се провежда следният експеримент в неорганичната химия: веществото се прекарва през бистър разтвор на вар. Наблюдението на мътността на разтвора поради утаяването на бяла утайка от калциев карбонат потвърждава наличието на молекули въглероден диоксид в сместа от реагенти. При по-нататъшно преминаване на газа през разтвора на калциев хидроксид, утайката СаСОз се разтваря поради превръщането му в калциев бикарбонат, водоразтворима сол.

Ролята на въглерода в домейн процеса
Химическите свойства на въглерода се използват в промишленото производство на желязо от неговите руди: магнитна, червена или кафява желязна руда. Главни сред тях ще бъдат редуциращите свойства на въглерода и оксидите - въглероден оксид и въглероден диоксид. Процесите, протичащи в доменната пещ, могат да бъдат представени като следната последователност от реакции:
- Първо, коксът изгаря в въздушен поток, загрят до 1850 ° С, за да образува въглероден диоксид: C + O2 = CO 2 .
- Преминавайки през горещ въглерод, той се редуцира до въглероден оксид: CO 2 + C = 2CO.
- Въглеродният оксид реагира с желязната руда, в резултат на което се получава железен оксид: 3Fe 2 O 3 + CO = 2Fe 3 O 4 + CO 2 ↑, Fe 3 O 4 + CO = 3FeO + CO 2 .
- Реакцията на получаване на желязо ще има следната форма: FeO + CO = Fe + CO 2
Разтопеното желязо разтваря в себе си смес от въглерод и въглероден окис, оказва се, че веществото - цементит.

Желязото, топено в доменната пещ, с изключение на желязото, съдържа до 4,5% въглерод и други примеси: манган, фосфор, сяра. Стоманата, която се отличава от чугуна с редица характеристики, например способността му да се валцува и кова, има в състава си само 0,3 до 1,7% въглерод. Стоманени продукти се използват широко в почти всички индустрии: машиностроене, металургия, медицина.
В нашата статия открихме какви химически свойства на въглерода и неговите съединения се използват в различни сфери на човешката дейност.