Осмотичен натиск в природата и човешкия живот
Материалите, предоставени за Вашия преглед, ще предоставят информация за осмотичното налягане (g). По-долу ще бъдат разгледани: формулирането на термина, характеристиките и свойствата, методите за измерване на налягането, връзката с биологията и връзката с решенията (pp) на различни типове.
Запознаване с осмотично налягане
Осмотичното налягане е превишението на хидростатичното налягане, упражнявано върху разтворите. В същото време, самите разтвори трябва да бъдат разделени от полупропусклив мембранен тип от чисти разтворители. Процесът на разтваряне на дифузията през мембраната при такива условия не настъпва. Целта на този натиск е да се стреми да създаде равен баланс между концентрациите на всякакви разтвори, а средството е срещата на молекулната дифузия между разтвореното вещество и разтворителя. Осмотичното налягане се обозначава с буквата "π" (pi).
За имотите
Осмотичното налягане има феномен на тоничност, който е градиентна мярка на осмотичното налягане. С други думи, това е потенциалът на водната разлика в чифт р-ров, разделен от полупропусклива мембрана. Хипертоничен разтвор наименовайте веществото, което в сравнение с друг разтвор има по-високо осмотично налягане. Хипотоничният разтвор, напротив, има по-нисък осмотичен индекс.
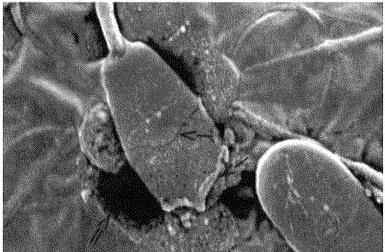
Ако такова решение се постави в затворено пространство, например в кръвна клетка, тогава ще видим, че осмотичното налягане може да се счупи. клетъчна мембрана. Лекарствата, въведени в кръвта, първо се смесват с изотоничен р-ром, което ги води до разтваряне именно поради тази причина. С това натриев хлорид в разтвора трябва да се съдържа в количество, способно да балансира осмотичния ефект на клетъчната течност.
Ако лекарствата от администриран тип са направени на базата на вода или силно разредени разтвори, осмотичното разлагане би разрушило кръвните клетки, като принуди водата да проникне в тях. Създаването на решения с използване на твърде високи концентрации на вещества ще принуди водата да напусне клетките и в резултат ще се свият. За това е достатъчно от три до десет процента натриев хлорид в p-re.
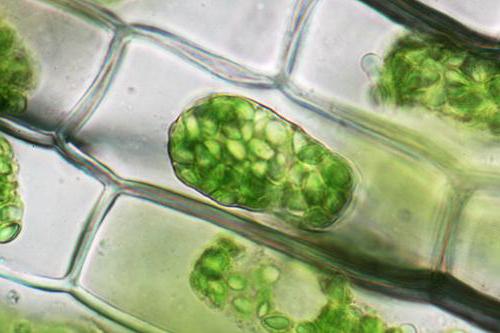
Растителните клетки, за разлика от животните, ще бъдат подложени на отделяне от клетъчната стена, цялото му съдържание, с изключение на външната клетъчна стена, но заедно с мембраната. Това явление се нарича плазмолиза. Deplazmolizom, от своя страна, е процесът, наблюдавани при преместване на сгънати клетки в pp от по-разреден тип.
Връзката на налягането и разтвора
Химичната природа на разтворените вещества в съединението не влияе върху величината на осмотичния ефект. Скоростта му зависи от количеството на тези вещества в р-р. Следователно, ние виждаме, че осмотичното налягане е колегиращо свойство на разтвора. Налягането ще нараства с увеличаване на концентрацията на активните вещества в р-ре. Това е показано от закона за осмотичното налягане. Формулата е съвсем проста:
π = i · C · R · T ,
където изотоничен коефициент е обозначена с буквата i , моларното ниво на концентрацията на p-ra се изразява с C (mol / m 3 ), универсалният газов индекс на неговата константа е означен с буквата R, а T е термодинамичното ниво на p-ra температурата.
Формулата е подобна на идеалния газ. Частици във въздуха перфектен газ в среда с разтворител от вискозен тип сходствата в техните свойства също показват общите им характеристики. Това твърдение потвърждава редица експерименти, проведени от J. B. Перин през 1906 година. Той наблюдава процеса на разпределение на емулсионните частици на гуммиговой смола във водния стълб, който обикновено се подчинява на закона на Болцман.
Има концепция за онкотично осмотично налягане, което зависи от количеството протеини в разтвора. В резултат на гладуване или бъбречно заболяване, концентрацията на протеини ще намалее. По тази причина онкотичното налягане ще падне и ще започнат да се появяват отоци от онкотичен характер. Ще има прехвърляне на вода от тъканите към съдовете, към тези места, където е включен повече. Гнойните процеси водят до увеличаване на π onc два до три пъти. Това се дължи на разрушаването на протеини, което води до увеличаване на броя на частиците.
Стабилният осмотичен индекс трябва да бъде приблизително 7,7 атм. По тази причина изотоничните разтвори обикновено съдържат около π от плазмата = 7.7 atm. Решения с π превишава π на плазмата , използва се за отстраняване на гной от рани или премахване на оток от алергичен характер. Те са и слабителни лекарства.
Термодинамичен изглед на осмотичното налягане
Формулата Vant-Hoff, използвана за осмотично лечение, може да бъде оправдана от термодинамична гледна точка.

Свободната енергия, която е в разтвор, ще съответства на G = G 0 + RTlnx A + π V C. Моларната част на разтвора ще бъде означена с x A , V C - това е индикатор за моларния обем. Терминът π V е еквивалентен на въвеждането на свободната енергия на външното налягане. Чистият разтворител има G = G0 . Ако равновесният индекс G на разтворителя съответства на индикатора 0, тогава получаваме:
0 = = G = G 0 + RTlnx A + π V C - G 0 = RT lnx A + π V C.
Полученият запис може да се преобразува във формулата на van't Hoff.
За колоидните разтвори
Осмотичното налягане на разтвора може да възникне, ако са налице две условия:
- Необходима е полупропусклива преграда (мембрана).
- Наличието на два разтвора от двете страни на мембраната, докато разтворите трябва да бъдат с различни концентрации.
Клетъчната мембрана може да премине частици със специфични размери, например, да допусне и да освободи водната молекула, но има обратен ефект върху C2H6O. Така, използвайки специални материали, които също имат такава възможност за разделяне, е възможно да се разделят различните компоненти на сместа.
Осмотичните разтвори се изчисляват като се използва π = cRT. Тази формула е извлечена от Вант-Хоф през 1885 г. и експериментите на Пфефер с порест порцелан са послужили като основа за откриването му.
Тургор в клетка
Осмозата и осмозата са много важни компоненти на много биологични системи. Ако структурата съдържа полупропусклива преграда (специфична тъкан или клетъчна стена), тогава постоянната скорост на осмоза на водата ще създаде твърде много хидростатично налягане и в резултат ще се образува тургор, който ще осигури силата и устойчивостта на тъканите.
Може би феноменът на хемолиза, който е разкъсване на клетъчната мембрана, като еритроцитите в резултат на прекомерното му подуване, когато е поставен в пречистена вода.
плазмолиза
Противоположните процеси ще настъпят, когато клетката се постави в разтвори на сол на концентриран тип: водата, съдържаща се в клетката, ще дифундира в солените разтвори през мембраната. В резултат на това клетката ще се свие, като загуби тургора на стабилно състояние. Това явление се нарича плазмолиза. Въпреки това тургорът може да бъде възстановен чрез поставяне на плазмолизираната клетка в протоплазмената вода. Клетъчният обем ще се поддържа само в изотоничен р-р със същата концентрация (постоянно осмотично).
Обобщава
Този материал позволи на читателя да се запознае с концепцията за осмотично лечение, да формулира обща представа за него и да научи много интересни неща. Например, сходството на изчислението на формулата с формулата на Вант Хоф, сходството с идеалния газ, ролята в биологичните процеси и последствията, които те могат да причинят, а именно тургор, плазмолиза, хемолиза и много други.