Хомогенни реакции: описания и примери
За правилните химични реакции е важно да знаете условията, при които те се срещат. Хомогенната среда на реагентите позволява определянето на скоростта на тяхното взаимодействие. Има специални фактори, които могат да забавят или ускорят хомогенните реакции.
класификация
Химичните взаимодействия могат да се разделят на различни групи поради наличието на голям брой критерии. 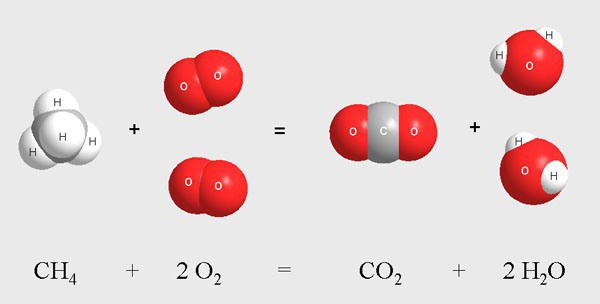
Има следните знаци:
- Наличието на участъка от реакционната фаза. Реакциите могат да бъдат хомогенни или хетерогенни.
- Промяна в степента на окисляване на реагиращите вещества.
- Топлинно освобождаване или абсорбция.
- Видът на промяната на реагиращите вещества, свързани с съединението, разлагане, заместване или обмен.
Хомогенна среда
Това е хомогенна система, в която химичните и физическите характеристики на компонентите във всяка точка са постоянни и ако се променят, тогава с непрекъснато темпо, без появата на остри скокове. Всичките му части нямат повърхностно разделяне. Така тече хомогенно химични реакции.
Ad
Наличието на няколко реагента в хомогенна фаза не може да бъде визуално определено или механично разделено. Тази характеристика е възможна поради равномерното разпределение на съставните частици на един компонент в друг.
Примери за хомогенни фази включват газови смеси, замразена вода и разтвори в течна или твърда форма.
Определяне на хомогенни взаимодействия
Те се наричат още хомофазни реакции. Това са процеси, протичащи в областта на една хомогенна среда, и реагиращите компоненти и получените продукти са в постоянно състояние. 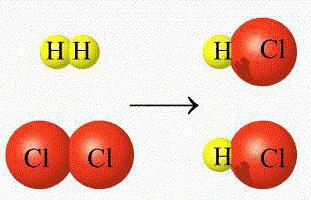
Хомогенните реакции имат стойности, които остават същите, и ако се променят, тогава с непрекъсната скорост.
Когато процесите протичат в зоната на разделяне на две фази, те се наричат хетерогенни.
Ако реакциите са многостепенни, те могат да бъдат от смесен тип. В тях началните етапи протичат в хомогенна среда и крайните процеси в хетерогенната фаза. Такива взаимодействия най-често се срещат в природата.
Ad
Хомогенни реакции, примери за уравнения
Те включват процеса на хлориране на метановите молекули в газообразна среда. Тази реакция протича при високи температури или при излагане на ултравиолетова радиация. В резултат на смесването на метан и хлор се осъществява фазово взаимодействие от екзотермичен тип.
Междинните продукти са газообразни вещества, които включват молекули от хлорометан, дихлорометан, трихлорметан, хлороводород. По време на реакцията се наблюдава постепенно заместване на водородните атоми в метан с хлорни атоми. Крайното вещество е тетрахлорметан.  Всички етапи протичат в газообразната среда, посочена със стрелка нагоре. Схематично процесът изглежда така:
Всички етапи протичат в газообразната среда, посочена със стрелка нагоре. Схематично процесът изглежда така:
Н2СН2 + + С1С1 + → Н2СНС1 + НС1
Н2СНС1 + С1С1 + → Н2СС12 + НС1
H 2 CC 2 2 + ClCl 6 → HCl 3 + НС1
HCCI 3 + + ClCl + CCI4 + НС1
Има и едноетапни хомогенни реакции. Примери за такива взаимодействия са изброени по-долу.
Хомофазните процеси включват:
- разделяне на пентавалентен азотен оксид в газообразна среда под действието на висока температура: N 2 O 5 ↑ + N 2 O 5 → NO2 + NO2 + NO2 + NO2 + O2;
- неутрализиращ разтвор натриев хидроксид разтвор на солна киселина за образуване на разтвор натриев хлорид и вода: НС1 + NaOH → NaCl + Н20;
- изгаряне на етан с освобождаване на тетравалентен въглероден оксид и водна пара: С 2 Н 6 С + С 2 Н 6 7 + 7О 2 4 → 4СО 2 + 6Н 2 О ↑;
- превръщане на молекулен кислород по време на гръмотевична буря в озон: 3O 2 2 → 2O 3 ↑.
Хомогенните реакции често се срещат в течна среда. Те включват процесите на халогениране, разделянето на различни комплексни съединения на по-прости или радикали, заместването на някои атоми с друг нуклеофилен или електрофилен тип, елиминирането на части от молекулата или тяхното пренареждане, удължаване на веригата поради полимеризация, окислително взаимодействие. В резултат се образуват течни продукти.
Скоростта на реакцията е хомогенна
Ходът на процеса може да отнеме различни интервали от време. Важна характеристика на това взаимодействие е скоростта на хомогенна реакция. Той представлява цифрова стойност, която определя промяната в концентрацията на всеки реактив за определен период от време. 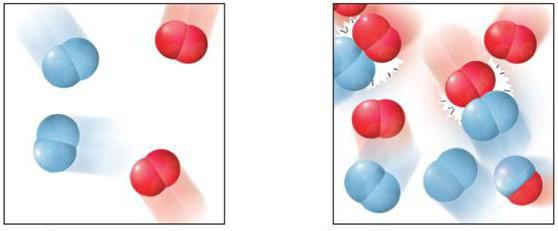
Тя може да бъде характеризирана по различен начин: като стойност, която установява промяна в броя на взаимодействащия компонент в даден обем за определено време. Основното условие е липсата на масова промяна в системата.
Ad
При изчисляване на скоростта на реакцията в хомогенна среда (обозначена като V), се използва намаление или увеличаване на моларното количество на реагента (Ci) за определено време (t). Има специална формула за изчисляване:
V i = ± C i / t.
За химичния процес НС1 + NaOH → NaCl + H 2 O, скоростта на потока може да се определи чрез намаляване на концентрацията на всеки реагент. (солна киселина или натриев хидроксид) или чрез увеличаване на количеството на продуктите на конверсия (натриев хлорид или вода) за период от време при постоянни температурни условия.
За да се определи скоростта на хомогенни реакции, концентрацията се взема в мола на литър, а времето се измерва в секунди. Изчислението е както следва:
Vi = ± Cj / t = - [НС1] / t = - [NaOH] / t = [NaCl] / t = [Н20] / t.
Фактори, влияещи върху скоростта
Реакцията е хомогенна, при която скоростта на даден процес е право пропорционална на дадено вещество на единица обем. Колкото повече молекули са включени, толкова по-бързо е взаимодействието. 
Основните фактори, влияещи върху скоростта на процесите в хомогенна среда, са концентрацията на реактивите и реакционните продукти, тяхната химична природа, температурни условия, налягане в реакционния обем, както и наличието на ускорители, които катализират промените.
Ad
Зависимостта на скоростта на реакциите при нагряване е установена от учения Вант Хоф. Според него всяко увеличение на температурата с 10 ° увеличава скоростта в хомогенни реакции с 2 или 4 пъти. В по-топла среда молекулите започват да се движат по-активно, сблъскват се помежду си, което води до тяхното взаимодействие.
С течение на времето хомогенните реакции протичат с различна интензивност, поради което скоростите им могат да бъдат верни (в определен момент) и средни, което трябва да се вземе предвид при изчисленията.