Електролитна дисоциация: уравнение, степен, константа, реакция
Основният стълб на химията, наред с периодичната система на Д. И. Менделеев, структурата на органичните съединения от А. М. Бутлеров, други значими открития, е теория на електролитна дисоциация. През 1887 г. той е разработен от Svante Arrhenius, за да обясни специфичното поведение на електролитите във вода, други полярни течности и стопи. Той намери компромис между две категорично различни теории за решения, които съществуват по това време - физически и химически. Първата заявява, че разтвореното вещество и разтворителят не взаимодействат помежду си, образувайки проста механична смес. Втората е, че има химическа връзка между тях. Оказа се, че всъщност тези и други свойства са присъщи на решенията.
В следващите етапи от развитието на науката много учени продължават изследванията и развитието в тази област, като разчитат на наличната информация за структурата на атомите и естеството на химическите връзки между тях. В частност, И. А. Каблуков се занимава с въпроса за процесите на солватация, а В. А. Кистяковски определя зависимостта на издигането на колона от течност в капиляра при условия на точка на кипене върху молекулното тегло.
Съвременната интерпретация на теорията
Преди откриването на това откритие много от свойствата и обстоятелствата на процесите на разделяне не са изследвани, както и самите решения. Електролитна дисоциация е процес на разграждане на веществото в съставните й йони във вода или други полярни течности, взаимодействието на съставни частици с молекулите на разтворителя, появата на подвижност на катиони и аниони в решетъчните места поради топене. В резултат на това образуваните вещества получават ново свойство - електрическа проводимост.
 Йони, които са в свободно състояние на разтвора или се стопяват, взаимодействат помежду си. Вероятно заредените отблъскват се взаимно - привличат се. Заредените частици се разтварят чрез молекули на разтворителя - всеки е плътно заобиколен от строго ориентирани диполи според силите на привличане на Кулон, в конкретния случай те са хидратирани, ако средата е водна. Катионите винаги имат големи радиуси, отколкото анионите, поради спецификата на местоположението на частиците около тях с локализирани на ръбовете заряди.
Йони, които са в свободно състояние на разтвора или се стопяват, взаимодействат помежду си. Вероятно заредените отблъскват се взаимно - привличат се. Заредените частици се разтварят чрез молекули на разтворителя - всеки е плътно заобиколен от строго ориентирани диполи според силите на привличане на Кулон, в конкретния случай те са хидратирани, ако средата е водна. Катионите винаги имат големи радиуси, отколкото анионите, поради спецификата на местоположението на частиците около тях с локализирани на ръбовете заряди.
Състав, класификация и наименования на заредени частици в светлината на електролитна дисоциация
Йонът е атом или група от атоми, които са носители на положителен или отрицателен заряд. Те имат конвенционалното разделение на прости (K (+) , Ca (2+) , H (+) - състоящи се от един химичен елемент), комплексни и комплексни (OH (-) , SO 4 (2-) , HCO 3 (- ) - от няколко). Ако катион или анион е свързан с молекула на разтворител, той се нарича солватиран, с дипол на Н2О молекулата хидратиран.
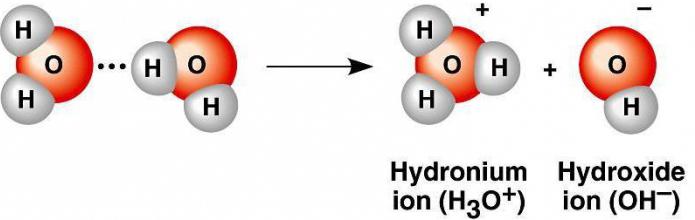
При електролитна дисоциация на вода се образуват две заредени частици Н (+) и ОН (-) . Протонът на водорода приема единствената електронна двойка кислород от друга молекула на водата до свободната орбита, в резултат на което се образува хидроксиевият йон Н3О (+) .
Основните разпоредби на откритието на Arrhenius
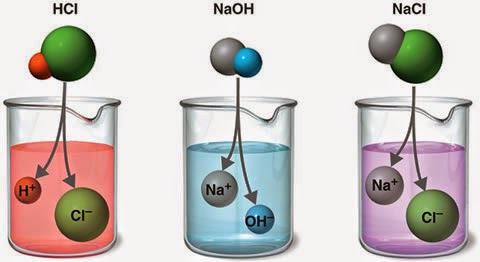
Всички представители класове неорганични съединения в допълнение към оксидите, в разтворите на ориентирани диполи течности се разпадат, по химичен начин, те се дисоциират в техните съставни йони в по-голяма или по-малка степен. Наличието на електрически ток не изисква този процес, уравнението на електролитна дисоциация е неговия схематичен запис.
Влизайки в разтвора или стопилката, йоните могат да бъдат изложени на електрически ток и да се движат по посока на катода (отрицателен електрод) и анода (положителен). Последните привличат противоположно заредени атомни агрегати. Оттук и частиците и техните имена - катиони и аниони.

В същото време и едновременно с разпадането на дадено вещество се осъществява обратен процес - свързването на йони към оригиналните молекули, следователно, стопроцентово разтваряне на веществото не настъпва. Такова уравнение за реакцията на електролитна дисоциация съдържа знак за равенство между дясната и лявата страна. Електролитна дисоциация, подобно на всяка друга реакция, се подчинява на законите, регулиращи химическото равновесие, не е изключение и законът на масовото действие. Той заявява, че скоростта на разпад в йони е пропорционална на концентрацията на електролита.
Класификация на веществата по време на дисоциация
Химичната терминология разделя веществата на неразтворими, слабо разтворими и разтворими. Последните две са слаби и силни електролити. Информацията за разтворимостта на някои съединения е обобщена в таблицата на разтворимостта. Дисоциацията на силни електролити е необратим процес, те са напълно разложени на йони. Слабите са само частично, те са присъщи на феномена на асоциация и следователно на равновесието на протичащите процеси. 
Важно е да се отбележи, че няма пряка връзка между разтворимостта и електролитната якост. В силните може да е леко. Както и слабите електролити могат да бъдат добре разтворими във вода.
Примери за съединения, чиито разтвори провеждат електричество
Класът "силни електролити" включва всички добре дисоцииращи киселини, като азотна, солна, бромова, сярна, перхлорна и други. Алкалните хидроксиди и отделните представители на групата "алкалоземни метали" са еднакво сходни. Интензивна електролитна дисоциация на соли, с изключение на някои цианати и тиоцианати, както и на живачен (II) хлорид.
Класът "слаби електролити" е представен от останалите минерали и почти всички органични киселини: въглеродни, сулфид, бор, азот, сяра, силиций, оцетна и други. Както и слабо разтворими и въглеводородни основи и амфотерни хидроксиди (магнезиев хидроксид, берилий, желязо, цинк в окислителни състояния (2+)). От своя страна водните молекули са много слаби електролити, но все още се разпадат на йони.
Количествено описание на процесите на дисоцииране
Степента на електролитна дисоциация всъщност характеризира мащаба на процеса на разделяне. Тя може да се изчисли - броят на частиците, разделени на йони, трябва да се раздели на общия брой молекули на разтвореното вещество в системата. Означаваме тази стойност с буквата "алфа". 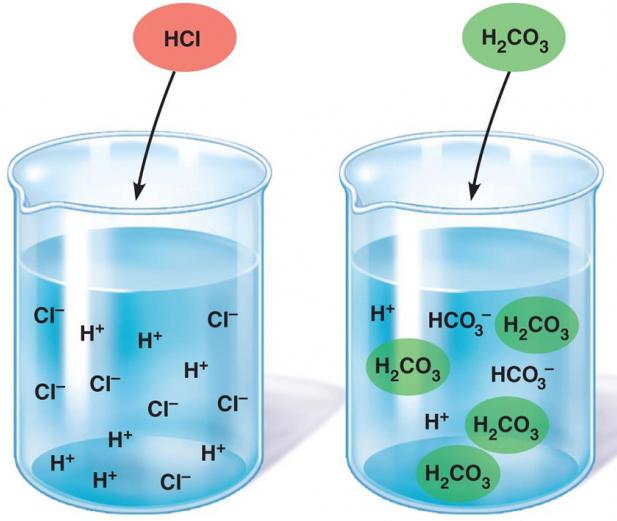
Логично е, че за силни електролити "а" е равен на един, или сто процента, тъй като броят на дезинтегрираните частици е равен на техния общ брой. За слабите - винаги по-малко от едно. Пълното разлагане на изходните молекули на йони във водна среда не настъпва и протича обратния процес.
Основни фактори, влияещи върху пълнотата на разпадане
Редица неоспорими фактори влияят върху степента на електролитна дисоциация. На първо място, природата на разтворителя и разлагащото се в него вещество е важно. Например, всички силни електролити имат ковалентно силно полярна или йонна връзка между съставните частици. Течностите са представени от диполи, по-специално вода, в молекули има разделяне на заряда и в резултат на тяхната специфична ориентация, настъпва електролитна дисоциация на разтвореното вещество.
Стойността на алфа е обратна на концентрацията. С увеличаването му стойността на степента на дисоциация намалява и обратно. Самият процес е изцяло ендотермичен, т.е. необходимо е определено количество топлина, за да се инициира. Влиянието на температурния фактор е оправдано както следва: колкото е по-високо, толкова по-голяма е степента на дисоциация.
Вторични фактори
Многоосновни киселини, като фосфорна киселина, и основи в състав с няколко хидроксилни групи, например, Fe (OH) 3 , се разлагат на йони на стъпки. Зависимостта се определя - всеки следващ етап на дисоциация се характеризира със степен, която е хиляди или десетки хиляди пъти по-малка от предходната.
Добавянето на други електролити към системата, променящо концентрацията на един от йоните на основното вещество, може също да промени степента на разлагане. Това води до изместване на равновесието в посоката, която се определя от правилото на Le Chatelier-Brown - реакцията протича в посоката, в която се наблюдава неутрализация на влиянието, упражнявано върху системата отвън.
Константа на класическия равновесен процес
За характеризиране на процеса на разлагане на слаб електролит, в допълнение към неговата степен, се използва константа на електролитна дисоциация (K d ), която се изразява в съотношението на концентрациите на катиони и аниони към количественото съдържание на началните молекули в системата. В действителност, обичайното постоянно химическо равновесие за обратимата реакция на разтвореното вещество в йони.
Например, за процеса на разлагане на съединението на съставните му частици, дисоциационната константа (K d ) ще бъде определена от частните постоянни концентрации на катиони и аниони в разтвора, повишени до степен, съответстваща на номерата, които са изправени пред тях в химическото уравнение, и общия брой оставащи недисоциирани формулни единици. разтворител. Зависимостта се проследява - колкото по-висока (K d ), толкова по-голям е броят на катионите и анионите в системата.
Отношението между концентрацията на слабо разпадащо се съединение, степента на дисоциация и константата се определя с помощта на закона на Оствалд за разреждане по уравнението: K d = α 2 s.
Вода като слабо дисоцииращо вещество
В много малка степен диполните молекули се разпадат в заредени частици, тъй като са енергийно неблагоприятни. И все пак има разцепване във водородни катиони и хидроксилни аниони. Като се имат предвид процесите на хидратация, може да се говори за образуването на йон на хидроксония и ОН (-) от две водни молекули.
Постоянната дисоциация се определя от съотношението на продукта на протоните на водородните и хидроксидните групи, наречени йонни продукти на водата, към равновесната концентрация на непрекъснатите молекули в разтвора.
Електролитна дисоциация на вода води до наличието в системата Н (+) , които характеризират неговата киселинност, и наличието на ОН (-) - базичност. Ако концентрациите на протонните и хидроксилните групи са равни, тази среда се нарича неутрална. Налице е така наречения водороден индекс - това е отрицателният логаритъм на общото количество Н (+) в разтвора. РН по-малко от 7 показва, че средата е кисела, повече е за неговата алкалност. Това е много важно количество, според неговата експериментална стойност, биологична, биохимична и химични реакции различни водни системи - езера, езера, реки и морета. Значението на стойността на рН за промишлените процеси също е неоспоримо.
Запишете реакциите и обозначенията
Уравнението на електролитна дисоциация с помощта на химични признаци описва процесите на разпадане на молекули в съответни частици и се нарича йонно. Тя е много пъти по-проста от стандартната молекула и има по-общ вид. 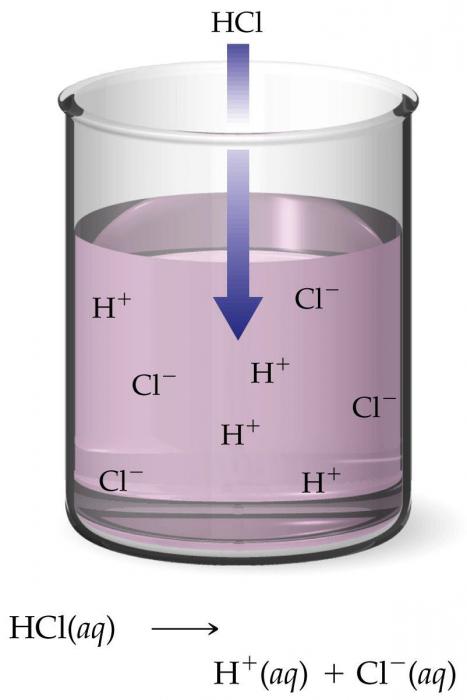
При съставянето на такова уравнение е необходимо да се има предвид, че веществата, които се утаяват или отстраняват от реакционната смес в състава на газовите пари по време на реакцията, трябва винаги да се записват само в молекулярна форма, за разлика от електролитните съединения, силните представители на които се разделят само на йони решения. Електролитна дисоциация за тях е необратим процес, тъй като свързването е невъзможно поради образуването на неразделящи се вещества или газове. За този тип уравнения се прилагат същите правила, както и за други химични реакции - сумата от коефициентите на лявата и дясната страна трябва да бъде равна една на друга, за да се поддържа материален баланс.
Електролитна дисоциация на киселини и основи може да се извърши на няколко етапа, ако веществата са многоосновни или поликиселини. За всяка подреакция напишете своето собствено уравнение.
Роля в химическата наука и нейното развитие
Създаването на теорията на Svante Arrhenius е от изключителна важност за общия процес на формиране на физическата и по-специално на електрохимичната наука. На базата на откриването на такова явление като електролитна дисоциация, електродни процеси, спецификата на преминаването на токове чрез различни среди, теорията за насочването на катодно-анодните потенциали, са получили интензивно развитие. В допълнение, теорията на решенията напредна значително. Безпрецедентните открития също очакваха химическа кинетика, областта на корозия на метали и сплави, както и работа по намирането на нови средства за защита срещу нея.
В съвременния свят все още има толкова много нови и непознати. Всеки ден учените се движат все повече и повече в познаването на такава велика дисциплина като химията. Електролитна дисоциация, както и нейните създатели и последователи завинаги заемат почтено място в контекста на развитието на световната наука.