Химични свойства на етилена. Етиленова формула
Ненаситените въглеводороди с двойна химична връзка в молекулите принадлежат към групата на алкените. Първи представител хомоложни серии е етен, или етилен, формулата на който е: С2Н4. Алкените често се наричат олефини. Името е историческо и произхожда от 18-ти век, след получаване на продукта от взаимодействието на етилен с хлор-етил хлорид, който има външен вид на мазна течност. Тогава ethen и наречен нефт газ. В нашата статия ще изследваме нейните химични свойства, както и нейното производство и използване в промишлеността.
Връзката между структурата на молекулата и свойствата на веществото
Според теорията за структурата на органичните вещества, предложена от М. Бутлеров, характеристиката на съединението напълно зависи от структурната формула и вида на връзките на неговата молекула. Химичните свойства на етилена се определят и от пространствената конфигурация на атомите, хибридизацията на електронните облаци и наличието на р-й връзка в нейната молекула. Два нехибридизирани p-електрона от въглеродни атоми се припокриват в равнината, перпендикулярна на равнината на самата молекула. Образува се двойна връзка, чието разкъсване определя способността на алкените за реакциите на прибавяне и полимеризация.

Физични свойства
Eten е газообразно вещество с фин мирис. Той е слабо разтворим във вода, но добре разтворим в бензен, тетрахлорметан, бензин и други органични разтворители. Въз основа на формулата на етилен C 2 H 4 , неговото молекулно тегло е 28, т.е. етиленът е малко по-лек от въздуха. В хомоложните серии алкени с увеличаване на тяхната маса, агрегатното състояние на веществата се променя според схемата: газ - течност - твърдо вещество.
Получаване на газ в лабораторията и промишлеността
Нагряване етилов алкохол до 140 ° С в присъствието на концентрирана сярна киселина етилен може да се получи в лабораторията. Друг метод е елиминирането на водородните атоми от алкановите молекули. Чрез действие с натриев или калиев каустик върху халоген-заместените съединения на наситени въглеводороди, например хлороетан, се екстрахира етилен. В промишлеността най-обещаващият начин да се получи това е преработката на природен газ, както и пиролиза и крекинг на масло. Всички химични свойства на етилен - хидратация, полимеризация, добавяне, окислителни реакции - се обясняват с наличието на двойна връзка в неговата молекула.
Взаимодействието на олефините с елементите на основната подгрупа на седмата група
Всички членове на хомоложните серии на етена прикрепят халогенни атоми в точката, където е свързана pi връзката в неговата молекула. Така, червено-кафявият воден разтвор на бром става безцветен, в резултат на което етиленовото уравнение е дибромоетан:
C2H4 + Br2 = C2H4Br2
Реакцията с хлор и йод протича по подобен начин, добавянето на халогенни атоми в него също се случва на мястото на унищожаване на двойната връзка. Всички съединения - олефини могат да взаимодействат с водородни халогениди: хлороводород, водороден флуорид и др. В резултат на реакцията на прибавяне, протичаща чрез йонния механизъм, се образуват вещества - халогенни производни на наситени въглеводороди: хлороетан, флуороетан.
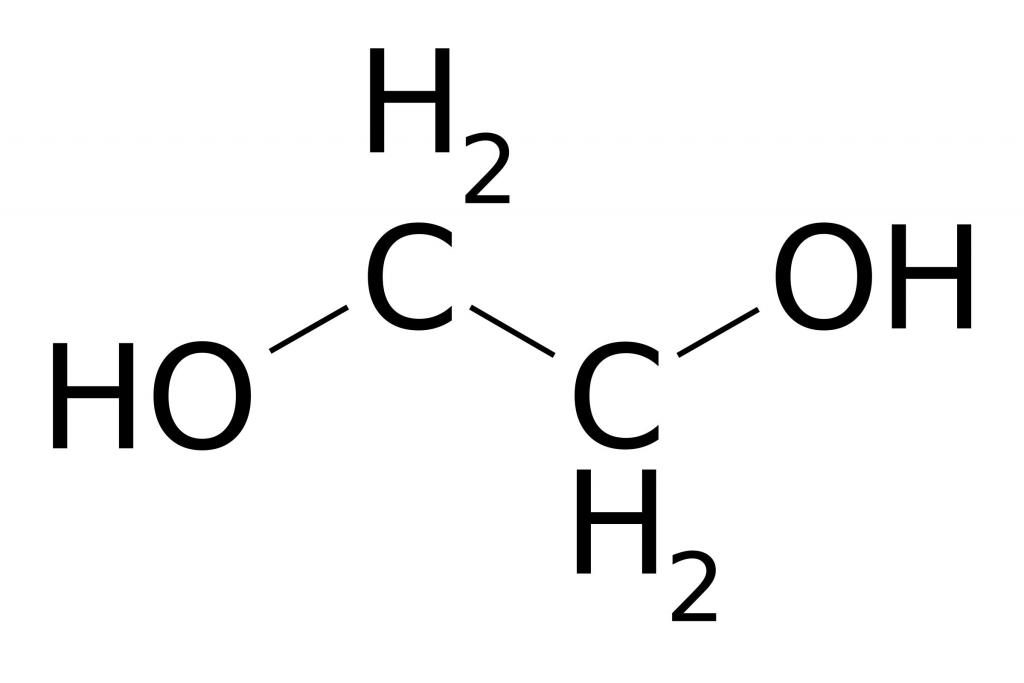
Производство на индустриален етанол
Химичните свойства на етилена често се използват за получаване на важни вещества, които се използват широко в промишлеността и ежедневието. Например, нагряване на етен с вода в присъствието на фосфорна или сярна киселина, под действието на катализатор, настъпва процес на хидратация. Той е свързан с образуването на етилов алкохол - многотонен продукт, получен в химически заводи за органичен синтез. Механизмът на реакцията на хидратация протича по аналогия с други реакции на прибавяне. В допълнение, взаимодействието на етилен с вода също се появява в резултат на разкъсване на р-й връзка. Свободните валенции на въглеродните атоми на етена са свързани с водородни атоми и хидроксилната група, които са част от водната молекула.
Хидрогениране и горене на етилен
Независимо от гореизложеното, реакцията на водородно съединение е от малко практическо значение. Той обаче показва генетичната връзка между различните класове органични съединения, в този случай алкани и олефини. Чрез добавяне на водород етенът се превръща в етан. Обратният процес е откъсване от наситени въглеводороди Водородните атоми водят до образуването на представителни алкени - етен. Силното окисление на олефините, наречено горене, е съпроводено с освобождаване на големи количества топлина, реакцията е екзотермична. Горивните продукти са еднакви за вещества от всички класове въглеводороди: алкани, ненаситени съединения на етилен и ацетиленови серии, ароматни вещества. Те включват въглероден диоксид и вода. Въздухът реагира с етилен, за да образува експлозивна смес.

Реакции на окисляване
Eten може да се окислява с разтвор. калиев перманганат. Това е една от качествените реакции, които доказват наличието на двойна връзка в състава на веществото, което се определя. Виолетовият цвят на разтвора изчезва поради счупването на двойната връзка и образуването на двуатомна граница алкохол - етилен гликол. Продуктът от реакцията има широк спектър от промишлени приложения като суровина за производството на синтетични влакна, като лавсан, експлозиви и антифриз. Както можете да видите, химичните свойства на етилена се използват за получаване на ценни съединения и материали.
Полимеризация на олефини
Повишаването на температурата, увеличаването на налягането и използването на катализатори са необходими условия за провеждане на процеса на полимеризация. Механизмът му е различен от реакциите на прибавяне или окисляване. Той представлява последователното свързване на много молекули етилен в точките на скъсване на двойните връзки. Реакционният продукт е полиетилен, чиито физични характеристики зависят от стойността на n, степента на полимеризация. Ако е малък, тогава веществото е в течно агрегирано състояние. Ако фигурата приближава 1000 връзки, тогава полиетиленово фолио и гъвкави маркучи са направени от такъв полимер. Ако степента на полимеризация надвишава 1500 единици във веригата, материалът е бял твърд, мазен на допир.

Той отива в производството на твърди продукти и пластмасови тръби. Етиленово халогенирано съединение - Тефлонът има анти-огневи свойства и е широко използван полимер, който се изисква при производството на мулти-готварски печки, тигани, чинии. Високата му способност да издържа на абразия се използва при производството на смазочни материали за автомобилните двигатели, а ниската му токсичност и толерантност към тъканите на човешкото тяло направи възможно използването на тефлонови протези в хирургията.

В нашата статия изследвахме химичните свойства на олефините, като изгаряне на етилен, добавяне, окисление и полимеризация.