Натриев бикарбонат: формула, състав, употреба
Сода за печене или печене е съединение, което е добре познато в медицината, в кухнята и в домакинството. Това е кисела сол, молекулата на която се формира от положително заредени йони на натрия и водорода, аниона на киселинния остатък на въглеродната киселина. Химичното наименование на содата е бикарбонат или натриев бикарбонат. Формулата на съединението съгласно системата Хил е: CHNaO 3 (брутна формула).
Разликата между кисела сол и среда
Въглеродната киселина образува две групи соли - карбонати (средни) и бикарбонати (кисели). Тривиалното наименование на карбонатите - сода - се появи в древността. Необходимо е да се прави разлика между средни и кисели соли по име, формула и свойства.
Na2CO3 - натриев карбонат, динатриева сол на въглена киселина, калцинирана сода. Служи като суровина за стъкло, хартия, сапун, използва се като детергент.

NaHC03 - натриев бикарбонат. Съставът предполага, че веществото е мононатриева сол на въглена киселина. Това съединение се характеризира с наличието на две различни положителни йони - Na + и H + . Външно кристални бели вещества са сходни, трудно се различават един от друг.
Веществото NaHCO 3 се счита за сода за хляб, не защото се поглъща за утоляване на жаждата. Въпреки че с това вещество можете да направите газирана напитка. Разтвор на този бикарбонат се приема перорално с повишена киселинност на стомашния сок. Когато това се случи, неутрализирането на излишните протони Н + , които дразнят стените на стомаха, причиняват болка и парене.
Физични свойства на содата
Бикарбонатите са бели моноклинни кристали. Съставът на това съединение съдържа атоми на натрий (Na), водород (Н), въглерод (С) и кислород. Плътността на веществото е 2,16 g / cm3. Точка на топене е 50–60 ° С. Натриев бикарбонат - млечнобял прах - твърдо кристално съединение, разтворимо във вода. Сода за пиене не изгаря, а при нагряване над 70 ° С се разлага на натриев карбонат, въглероден диоксид и вода. В производствени условия по-често се използва гранулиран бикарбонат.

Безопасност на содата за хора
Съставът няма мирис, вкусът му е горчиво-солен. Въпреки това, не се препоръчва да се мирише и вкус на веществото. Вдишването на натриев бикарбонат може да предизвика кихане и кашлица. Едно приложение се основава на способността на содата да неутрализира миришещите вещества. Прахът може да бъде обработен спортни обувки, за да се отървете от неприятната миризма.
Питейната сода (натриев бикарбонат) е безвредно вещество в контакт с кожата, но в твърда форма може да предизвика дразнене на лигавицата на очите и хранопровода. При ниски концентрации разтворът не е токсичен, може да се приема перорално.
Натриев бикарбонат: формула на съединението
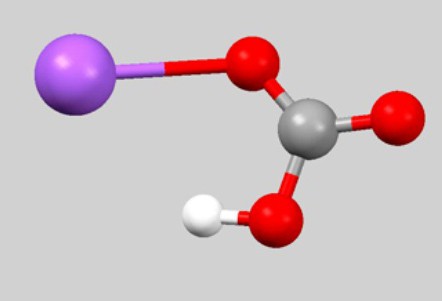
Брутната формула CHNaO 3 рядко се намира в уравненията на химичните реакции. Факт е, че той не отразява връзката между частиците, които образуват натриев бикарбонат. Формулата, която обикновено се използва за характеризиране на физичните и химичните свойства на веществото, е NaHC03. Взаимното подреждане на атомите отразява модела на молекулата на топката:
Ако научим от периодичната система стойностите на атомните маси на натрий, кислород, въглерод и водород. може да се изчисли моларната маса на веществото натриев бикарбонат (формула NaHCO 3 ):
Ar (Na) - 23;
Аг (О) - 16;
Ar (C) - 12;
Ar (H) - 1;
М (CHNaO3) = 84 g / mol.
Структура на веществото
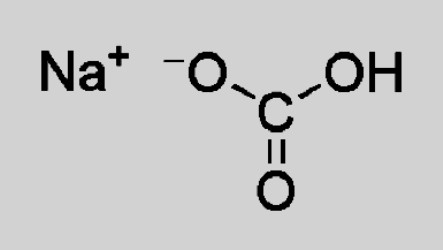
Натриевият бикарбонат е йонно съединение. Структурата на кристалната решетка включва натриев катион Na + , заместващ един въглероден атом в въглена киселина. Съставът и заряда на аниона - HCO 3 - . При разтваряне се получава частична дисоциация на йони, които образуват натриев бикарбонат. Формулата, отразяваща структурни характеристики, изглежда така:
Разтворимост на питейна сода във вода
7,8 g натриев бикарбонат се разтварят в 100 g вода. Веществото претърпява хидролиза:
NaHC03 = Na + + HC03;
Н2О = Н + + НЕ - ;
НСОз - + Н + = Н20 + СОг.
При сумиране на уравненията се оказва, че в разтвора се натрупват хидроксидни йони (слабо алкална реакция). Течни бои фенолфталеин в розово. Цветът на универсалните индикатори под формата на хартиени ленти в сода се променя от жълто-оранжево на сиво или синьо.
Реакция на обмен с други соли
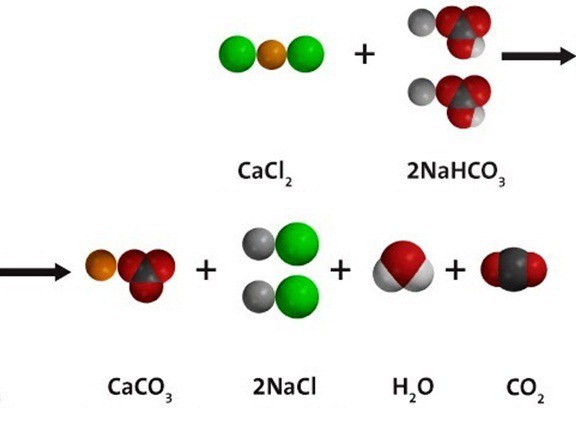
Воден разтвор на натриев бикарбонат влиза в йонообменна реакция с други соли, при условие, че едно от новополучените вещества е неразтворимо; или се образува газ, който се отстранява от сферата на реакцията. При взаимодействие с калциев хлорид, Както е показано на диаграмата по-долу, се получават и двете бели утайки от калциев сарбонат и въглероден диоксид. Натриеви и хлорни йони остават в разтвора. Уравнение на молекулярната реакция:
Взаимодействието на содата с киселини
Натриевият бикарбонат взаимодейства с киселини. Реакцията на йонен обмен се съпровожда от образуването на сол и слаба въглеродна киселина. В момента на получаването се разлага във вода и въглероден диоксид (изпарява).
Произвеждат се човешки стомашни стени солна киселина съществуващи под формата на йони
H + и Cl - . Ако приемате вътрешно натриев бикарбонат, реакциите се появяват в разтвор на стомашен сок с участието на йони:
NaHC03 = Na + + HC03;
НС1 = Н + + С1-;
Н2О = Н + + НЕ - ;
НСОз - + Н + = Н20 + СОг.
Лекарите не препоръчват постоянна употреба, когато висока киселинност стомаха натриев бикарбонат. Инструкциите към лекарствата изброяват различни странични ефекти от дневния и дългосрочния прием на сода за пиене:
- повишено кръвно налягане;
- оригване, гадене и повръщане;
- тревожност, лош сън;
- намален апетит;
- коремна болка.
Първи сода
В лабораторията натриев бикарбонат може да се получи от сода. Същият метод се използва и по-рано в химическата промишленост. Модерният индустриален метод се основава на взаимодействието на амоняк с въглероден диоксид и ниската разтворимост на питейна сода в студена вода. Чрез решението натриев хлорид преминават амоняк и въглероден диоксид (въглероден диоксид). Образуват се амониев хлорид и разтвор на натриев бикарбонат. Когато се охлажда, разтворимостта на питейната сода намалява, след което веществото лесно се отделя чрез филтрация.
Къде се използва натриев бикарбонат? Използването на сода за хляб в медицината
Много хора знаят, че атомите на металния натрий енергично взаимодействат с водата, дори и изпаренията му във въздуха. Реакцията започва активно и се придружава от отделянето на голямо количество топлина (изгаряне). За разлика от атомите, натриевите йони са стабилни частици, които не увреждат живия организъм. Напротив, те активно участват в регулирането на неговите функции.
Как се използва вещество, което не е токсично за хората и е полезно в много отношения - натриев бикарбонат? Приложението се основава на физичните и химичните свойства на содата за пиене. Най-важните области са вътрешното потребление, преработката на храни, здравеопазването, традиционната медицина и напитките.
Сред основните свойства на натриев бикарбонат е неутрализирането на повишената киселинност на стомашния сок, краткосрочното елиминиране на болката при хиперацидност на стомашния сок, пептичната язва и 12 дуоденална язва. Антисептичният ефект на разтвор на сода за пиене се използва при лечение на болки в гърлото, кашлица, интоксикация, морска болест. Те се измиват с устата и носа, лигавиците на очите.

Различни дозирани форми на натриев бикарбонат са широко използвани, например, прахове, които са разтворени и използвани за инфузии. Присвояване на решения за пациенти, които да получават вътрешността, измити с киселинни изгаряния. Натриевият бикарбонат се използва също за приготвяне на таблетки и ректални свещички. Инструкцията за препаратите съдържа подробно описание на фармакологичното действие, показания. Списъкът на противопоказанията е много кратък - индивидуалната непоносимост към веществото.
Използването на сода за хляб в ежедневието
Натриев бикарбонат е линейка за киселини и отравяне. С помощта на питейна сода у дома избелете зъбите, намалете възпалението в случай на акне, избършете кожата, за да отстраните излишната мастна секреция. Натриевият бикарбонат омекотява водата, помага за почистване на замърсявания от различни повърхности.
При измиване на ръцете от вълна може да се добавят в сода за питейна вода. Това вещество освежава цвета на тъканта и премахва миризмата на пот. Често при гладене на коприна се появяват жълти петна от желязото. В този случай, кашата от сода за пиене и вода ще помогне. Веществата трябва да се смесват възможно най-скоро и да се прилагат върху оцветяването. Когато кашата изсъхне, тя трябва да се почисти с четка и продуктът да се изплакне със студена вода.
В реакцията с оцетна киселина се получава натриев ацетат и въглеродният диоксид бързо се емитира, разпенвайки цялата маса: NaHC03 + CH3COOH = Na + + CH3COO - + Н20 + СОг. Този процес продължава, когато содата се угаси с оцет при производството на ефервесцентни напитки и сладкарски изделия.

Вкусът на печенето ще бъде по-мек, ако не използвате изкуствено приготвен изкуствен оцет, а лимонов сок. В краен случай можете да го замените със смес от 1/2 ч.л. лимонена киселина и 1 супена лъжица. л. вода. Пиенето на сода с киселина се добавя към тестото като една от последните съставки, така че веднага да поставите сладките във фурната. В допълнение към натриевия бикарбонат, амониевият бикарбонат понякога се използва като бакпулвер.