Водороден електрод: определение, устройство, формула и характеристики
В статията по-долу ние дефинираме значението на термина "водороден електрод". Не всеки знае какво е то. Тук ще бъде разкрито нейното общо значение. Ще обърнем внимание и на реакциите на окисление и редукция, които са свързани с вида на работа на подобен обект, и поотделно ще говорим за частите, които го образуват.
въведение
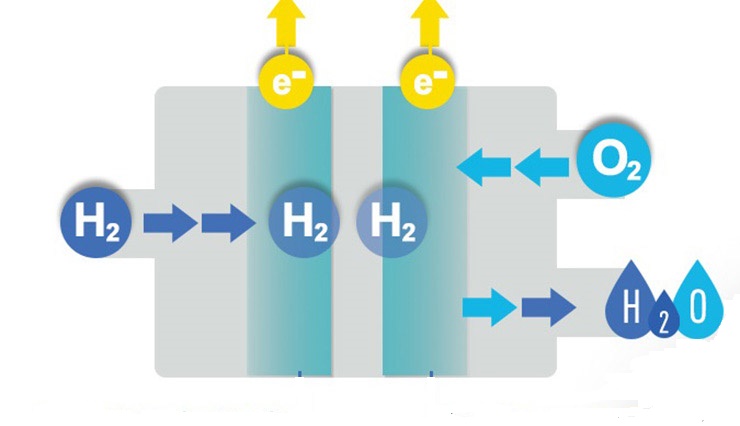
Стандартни водородни електроди, наречени референтни електроди. Те се използват в хода на измерванията на електрохимичния характер. Те намират и тяхното приложение в състава на галваничните клетки. Водородният електрод (EI) е метална пластина или тел, която абсорбира водород добре в газообразна форма. Самата плака е потопена във водни разтвори, наситени с кислород и съдържащи нейните йони.
Ad

Този елемент има потенциал поради концентрацията на Н + йони в дебелината на разтвора. Електродът се използва като еталон, спрямо който се определя потенциала на изследваните химични реакции. Ако налягането на водорода е равно на една единица атм., А концентрацията на протоните съответства на 1 mol / l, тогава потенциалът на VE се счита за равен на нула. Ако използвате платина като повърхност за специфична реакция, както и VE и определен електрод, тогава можете да наблюдавате интересна реакция, по време на която се образува стабилен водороден атом:
2Н + + 2е - = Н2.
С други думи, Н-атомите са редуцирани или окислени.Типът на реакцията се определя от потенциала на водородния електрод, върху който протича реакцията.
При измерване на ЕМП на галванични устройства, използващи стандартни условия (решението, за което говорихме по-горе), те винаги използват концепцията за стандартен електроден потенциал. Определя се вид химическа реакция.
Ad
Окисляване и редукция
Говорейки за водородни електроди, споменахме понятието окислителна и редукционна реакция, която може да се случи с водородни атоми при използване на съответните електроди.
Възстановяването в химията е явление, при което:
- Атомна, йонна частица или молекула приема (всеки) един или повече електрони.
- Наблюдава се намаляване на степента на окисление на определени атоми в дадена частица.
- Органичните вещества губят кислородни атоми и / или придобиват водород.
Преди това само третата дефиниция се счита за реставрация (от средата на деветнадесети век), докато първата и втората започват да се прилагат едва през 20-те години на миналия век. Днес се смята, че втората дефиниция може да се счита за обща за всички редукционни процеси в химията. С помощта на третия тип описание редокс реакциите често се изолират и разпознават.

Помислете повече. Под окисление се разбира процес, който се съпровожда от постепенно увеличаване на атома окислителни състояния определено вещество. Това се случва чрез "пренасянето" на електрони от донорния атом, който е отговорен за връщането на е - на акцепторния атом, който ще получи е - .
Въвеждането на термина в научното и ежедневното обръщение на езикови единици е задължително за академик В. М. Севергин. Това нововъведение е направено в началото на XVII и XIX век. Ученият използва този термин като процес на взаимодействие на кислород (съдържащ се във въздуха) с други вещества. Понякога окислителните реакции могат да доведат до образуването на нестабилни частици и тяхното последващо разлагане на по-малки съставни части на реакцията.
Ad
приложение
Водородните електроди най-често се използват за измерване на стандартен електрохимичен потенциал. Използва се също за определяне на нивото на концентрация на водородни йони и всякакви други видове йони. Дори и с използването на VE провеждайте изследвания, които помагат да се знае продуктът на разтворимостта по отношение на определената константа на скоростта в хода на някои електрохимични реакции.
Най-важните изисквания за референтния електрод са:
- Възможност за работа в температурни диапазони.
- Стабилност на работния процес.
- Способност за възпроизвеждане на резултата от реакцията и изследванията.
- Съвместимост с изследваната стопилка.
- Липса на стационарен потенциал.
Механизъм на устройството
Устройството на стандартните водородни електроди включва:
- Платинения електрод е елемент от системата, който има способността да изключи замърсяването на разтвора от външен ред йони по време на електролизата. Такива части нямат чисти повърхности (с изключение на относително тесни потенциални зони). Полето на реакция на веществата се нарича двуслойно. Характеризира се с факта, че тук са в контакт само метал, йони и разтворители. А последното е в специално състояние. В зависимост от стойността на потенциала, металът може да бъде покрит с водород в абсорбираща форма (ниска стойност) или с оксиди (висока стойност).
- Електролитният мост е средство за свързване на двете половини на галваничната структура на механизма.
- Подаване на газ водород.
- Киселинни разтвори (обикновено НС1) с концентрация на водородни катиони: H + = 1 mol / l.
- Запушване на проникването на кислородни молекули (от въздуха).

потенциал
За да се изчисли потенциалът на водородния електрод върху приложението на един електрод е невъзможно. Това твърдение обаче е валидно само за експериментални начини.
Потенциометричните средства, които играят важна роля в въпроса за електродния потенциал, се основават на дефиницията на електродвижещата сила (ЕМП):
E = E 1 -E 2 ;
Когато Е е дефинираната ЕМП, и Е 1 и Е 2 действат като потенциал на електродите на изследваната верига.
Как да се изчисли? Потенциалът на водородния електрод е равен на броя, който може да бъде определен с помощта на уравнението на Нернст:
E = E 0 + RT / Nf при вол / червено = E 0 + RT / nF в [ox] y ox / [red] y red
когато:
- E 0 - стандартната стойност на потенциала на редокс системата;
- R е газовата константа, равна на 8.312 J / (K mol);
- T е абсолютната стойност на температурата;
- F е константата на Фарадей (96485Cl / mol);
- n е броят на електроните, които са участници в реакцията;
- вол и червено са показатели за активността на различните форми на окислително-редукционната система (съответно окисление и редукция);
- [ox] и [red] - моларната концентрация на вещества, отговорни за явлението окисление или редукция;
- Гама [ox] и [red] - величината на коефициента на активност.

Исторически данни
СЕ се характеризира със сложността на работния процес. Въпреки това, той стана известен и започна да се използва за дълго време.
VE е патентован дизайн от P. P. L. Serensen. Той ги използва като централен инструмент за своите изследвания, което позволява появата на съвременната теория на рН-материята.
JF McClendon използва HE в редица първи експерименти за изследване на рН-метрията в стомаха. Как се случи това? Ученият използва референтен електрод, в който е поставен водороден електрод. Последният се въвежда заедно със сондата за рН вътре в човешкия стомах.