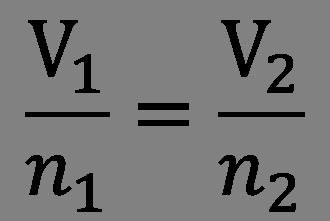Законът на Авогадро: Описание и биография на учен
За да предвидим резултатите от изследването, да предвидим модела, да почувстваме общия произход - всичко това бележи работата на голям брой експериментатори и учени. Най-често прогнозата се отнася само до областта на заетост на изследователя. И малцина имат смелостта да направят дългосрочно прогнозиране, значително преди време. Италианецът Амедео Авогадро имаше достатъчно смелост. Поради тази причина този учен вече е познат в целия свят. И законът на Авогадро все още се използва от всички химици и физици на планетата. В тази статия ще опишем подробно за него и неговия автор.
Детство и учене
Амедео Авогадро е роден в Торино през 1776 година. Баща му, Филип, работил като служител в съдебната система. Общо семейството имаше осем деца. Всички предци на Амедео служеха като адвокати в Католическата църква. Младият мъж също не се отклони от традицията и се зае със съдебната практика. На двадесетгодишна възраст той вече имаше докторска степен.
Ad
С течение на времето юридическата практика е престанала да примамва Amedeo. Интересите на младежа бяха в друга област. Още в младежките си години той посещава училище за експериментална физика и геометрия. Тогава, в бъдеще, ученът се събуди в любов към науката. Поради пропуски в знанията, Авогадро се самообучава. На 25 години Амедео посвещава цялото си свободно време на изучаването на математика и физика.
Научни дейности
На първия етап научната работа на Амедео беше посветена на изучаването на електрическите явления. Интересът на Авогадро стана особено силен, след като Волт открил източника на електрически ток през 1800-те години. Не по-малко интересен за младия учен бяха дискусиите на Волта и Галвани за природата на електричеството. И като цяло, тази област беше напреднала в науката.
Ad
През 1803 и 1804 г. Авогадро и брат му Феличе представят две творби на учените от Академията в Торино, които разкриват теории за електрохимични и електрически явления. През 1804 г. Амедео става член-кореспондент на тази академия.
През 1806 г. Авогадро си намери работа като учител в Торинския лицей. Три години по-късно, ученият се премества в Лицей на Верчели, където преподава математика и физика в продължение на десет години. По това време Амедео чете много научна литература, прави полезни извлечения от книги. Той ги доведе до края на живота. Имаше 75 тома от по 700 страници. Съдържанието на тези книги говори за гъвкавостта на интересите на учения и за колосалната работа, която той е извършил.
Личен живот
Амедео уреждал семейния живот доста късно, когато възрастта му вече беше преминала за третата дузина. Работейки във Верчели, той среща Анна ди Джузепе, която е много по-млада от учения. В този брак са родени осем деца. Никой от тях не последва стъпките на баща си.
Законът на Авогадро и неговите последствия
През 1808 г. Gay-Lussac (в сътрудничество с Humboldt) формулира принципа на обемните отношения. Този закон посочва, че съотношението между обемите на реагиращите газове може да бъде изразено прости числа. Например, 1 обем хлор, комбиниран с 1 обем водород, дава 2 обема хлороводород и т.н. Но този закон не даде нищо, защото, първо, нямаше конкретна разлика между понятията за корпускула, молекула, атом, и второ, учените имаха различни мнения за състава на частиците от различни газове.
Ad
През 1811 г. Амедео предприема задълбочен анализ на резултатите от изследванията на Gay-Lussac. В резултат на това Авогадро осъзнава, че законът на обемните отношения позволява да се разбере структурата на молекулата на газа. Хипотезата, която той формулира, гласи: "Броят на молекулите на всеки газ в един и същи обем винаги е един и същ."
Откриване на закона
В продължение на три години ученият продължава да експериментира. В резултат на това се появи законът на Авогадро, който звучи така: „Равни обеми газообразни вещества при една и съща температура и налягане съдържат същия брой молекули. Измерването на масата на молекулите може да се определи от плътността на различните газове. " Например, ако 1 литър кислород съдържа толкова молекули като 1 литър водород, то съотношението на плътността на тези газове е равно на масовото съотношение на молекулите. Ученият също отбелязва, че молекулите в газовете не винаги са съставени от единични атоми. Наличието на двата различни и идентични атома е приемливо.
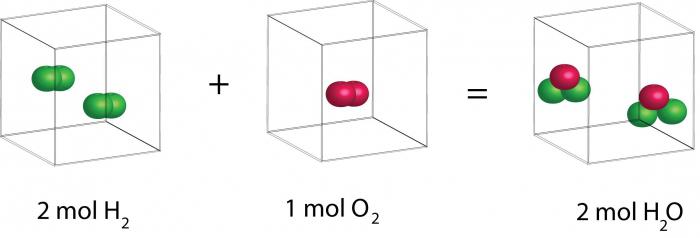
За съжаление по времето на Авогадро този закон не можеше да бъде доказан теоретично. Но той направи възможно да се установят в експерименти състава на газовите молекули и да се определи тяхната маса. Нека да следваме логиката на тези разсъждения. По време на експеримента беше установено, че водните пари от газа, както и обемът на водород и кислород са свързани в съотношение 2: 1: 2. От този факт можем да направим различни изводи. Първата: молекулата на водата се състои от три атома и молекула водород и кислород от две. Вторият извод също е подходящ: молекулите на водата и кислорода са двуатомни, а водородът е едноатомно.
Ad
Противниците на хипотезата
Законът на Авогадро имаше много опоненти. Това отчасти се дължи на факта, че в онези дни не е имало прост и ясен запис на уравненията и формулите на химичните реакции. Основният враг е Йенс Берцелиус, шведски химик с неоспорим авторитет. Вярваше, че всички атоми имат електрически заряди а самите молекули са съставени от атоми с противоположни заряди, които се привличат. Така водородните атоми имат положителен заряд, а кислородните атоми имат отрицателен. От тази гледна точка, кислородна молекула, състояща се от 2 еднакво заредени атома, просто не съществува. Но ако молекулите на кислорода са все още моноатомни, тогава в реакцията на азот с кислород съотношението на обемното съотношение трябва да бъде 1: 1: 1. Това твърдение противоречи на експеримента, където 2 литра азотен оксид бяха получени от 1 литър кислород и 1 литър азот. Поради тази причина Берцелиус и други химици отхвърлиха закона на Авогадро. В края на краищата, това абсолютно не съответства на експерименталните данни.
Съживяване на закона
Преди шестдесетте години на XIX в. В химията се наблюдава произвол. И тя се разшири като оценка молекулни тегла и описание на химичните реакции. Като цяло има много погрешни схващания за атомния състав на сложните вещества. Някои учени дори планираха да се откажат от молекулярната теория. И едва през 1858 г., един химик от Италия, наречен Cannizzaro, намира в кореспонденцията между Berthollet и Ampere препратка към закона на Avogadro и последствията от него. Това усъвършенства сложната картина на химията на времето. Две години по-късно Cannizzaro говори за закона на Авогадро в Карлсруе на Международния конгрес по химия. Докладът му направи незаличимо впечатление у учените. Един от тях каза, че като че ли виждаше очите си, всички съмнения се изпариха и в замяна се появи чувство на доверие.
След като законът на Авогадро беше признат, учените не само можеха да определят състава на газовите молекули, но и да изчислят атомните и молекулните маси. Тези знания помогнаха при изчисляването на масовите съотношения на реагентите в различни химични реакции. И беше много удобно. Чрез измерване на масата в грамове изследователите могат да работят с молекули.

заключение
Мина много време от откриването на закона Авогадро, но никой не е забравил за основателя на молекулярната теория. Логиката на учения е безупречна, което по-късно е потвърдено от изчисленията на Максуел, основани на кинетичната теория на газовете, а след това и експериментални изследвания. (Броуново движение). Също така беше определено колко частици се съдържат в мол от всеки газ. Тази константа - 6.022 • 1023 е наречена Номерът на Авогадро увековечавайки името на проницателния Амедео.