Видове химични връзки. Как да свържем атомите?
Химията е невероятна и, признавам, сложна наука. По някаква причина, тя е свързана с ярки експерименти, многоцветни епруветки, гъсти облаци пара. Но малко хора мислят откъде идва тази “магия”. В действителност, реакцията не протича без образуването на съединения между атомите на реагентите. Освен това, тези "джъмпери" понякога се намират в прости елементи. Те влияят върху способността на веществата да реагират и обясняват някои от техните физични свойства.
Какви химически връзки съществуват и как влияят на съединенията?
теория
Трябва да започнем с най-простите. Химическата връзка е взаимодействие, при което атомите на веществата се комбинират, за да образуват по-сложни вещества. Грешка е да се смята, че това е характерно само за съединения като соли, киселини и основи - дори простите вещества, чиито молекули се състоят от два атома, имат тези „мостове“, ако е така, може условно да наречем връзка. Между другото, важно е да се помни, че могат да се обединят само атоми с различни заряди (това са основите на физиката: еднакво заредени частици се отблъскват, а противоположните се привличат), така че в сложните вещества винаги има катион (йон с положителен заряд) и анион (отрицателна частица) и самата връзка винаги ще бъде неутрална.
Ad
Сега ще се опитаме да разберем как се образува химическа връзка.
Механизъм за образование
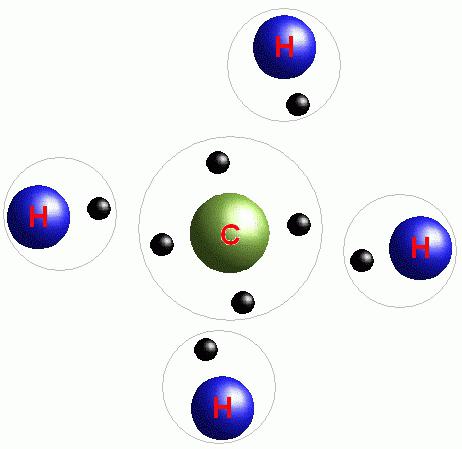
Всяко вещество има определен брой електрони, разпределени в енергийни слоеве. Най-външният слой, на който обикновено се намира най-малкото количество от тези частици, се счита за най-уязвимия. Можете да откриете техния брой, като погледнете номера на групата (ред с числа от една до осем в горната част на периодичната таблица), в който е разположен химическият елемент, а броят на енергийните слоеве е равен на броя на периодите (от една до седем, вертикалната линия вляво от елементите).
В идеалния случай има осем електрона във външния енергиен слой. Ако те не са достатъчни, атомът се опитва да ги изтегли от друга частица. Именно по време на процеса на селекция на електроните, необходими за завършване на външния енергиен слой, се образуват химически връзки. Броят им може да варира и зависи от броя на валентността, или несвързаните, частици (за да разберете колко от тях има в един атом, трябва да съставите електронната му формула). Броят на електроните, които нямат двойка, ще бъде равен на броя на образуваните връзки.
Ad
Малко повече за типовете
Видовете химически връзки, образувани по време на реакциите или просто в молекула на веществото, изцяло зависят от самия елемент. Има три вида "джъмпери" между атомите: йонни, метални и ковалентни. Последният, от своя страна, е разделен на полярни и неполярни.
За да разберем с какви връзки се свързват атомите, използвайте някакво правило: ако елементите са в дясната и лявата част на таблицата (т.е. те са метални и неметални, например NaCl), тогава тяхната връзка е отличен пример за йонна връзка. Две неметални форми ковалентна полярна връзка (НС1), и два атома от едно и също вещество, комбинирайки се в една молекула - ковалентен неполярен (Cl 2 , O 2 ). Горните видове химически връзки не са подходящи за вещества, състоящи се от метали - има само метална връзка.
Ad
Ковалентно взаимодействие
Както бе споменато по-рано, видовете химични връзки имат известно въздействие върху веществата. Например, ковалентният "мост" е много нестабилен, поради което съединенията с него лесно се унищожават с най-малкото външно влияние, например нагряване. Тя обаче се отнася само до молекулярните вещества. Тези, които имат немолекулна структура са практически неразрушими (перфектен пример е диамантен кристал - комбинация от въглеродни атоми).

Обратно към полярната и неполярната ковалентна връзка. При неполярния всичко е просто - електроните, между които се образува „мостът“, са на еднакво разстояние от атомите. Но във втория случай те се преместват в един от елементите. Победител в "свръхтягането" ще бъде субстанцията, чиято електронегативност (способността да привлича електрони) е по-висока. Тя се определя от специални таблици, и колкото по-голяма е разликата на тази величина между двата елемента, толкова по-полярна ще бъде връзката между тях. Вярно е, че единственото нещо, за което познаването на електроотрицателността на елементите може да бъде полезно, е дефиницията на катион (положителен заряд - вещество, което има по-малко количество) и анион (отрицателна частица с по-добра способност да привлича електрони).
Ad
Йонна връзка
Не всички видове химически връзки са подходящи за комбинация от метал и неметал. Както бе споменато по-горе, ако разликата в електроотрицателността на елементите е огромна (и това е случаят, когато те са разположени в противоположните части на таблицата), между тях се образува йонна връзка. В този случай, валентните електрони се прехвърлят от атом с по-ниска електронегативност към атом с по-голям, образувайки анион и катион. Най-забележителният пример за такава връзка е съединение на халоген и метал, например А1С1г или HF.
Метална връзка
С металите е все още по-лесно. Те са чужди на горните видове химически връзки, защото имат свои собствени. Той може да комбинира двата атома на едно вещество (Li 2 ) и различни (AlCr 2 ), като в последния случай се образуват сплави. Ако говорим за физически свойства, тогава металите съчетават в себе си пластичност и сила, т.е. те не се сриват при най-малкото въздействие, а просто променят формата.

Междумолекулна връзка
Между другото, съществуват и химически връзки в молекулите. Те се наричат междумолекулни. Най-често срещаният тип е водородно свързване, при което водороден атом заема електрони от елемент с висока електронегативност (например от водна молекула).