Първият закон на термодинамиката е обяснение на този закон и практически примери.
Физическите процеси като топлина и работа могат да се обяснят с простото прехвърляне на енергия от едно тяло в друго. В случай на работа, става въпрос за механична енергия Топлината приема топлинна енергия. Преносът на енергия се извършва съгласно законите на термодинамиката. Основните точки на този раздел на физиката са известни като „начало”.
Първият закон на термодинамиката регулира и ограничава процеса на пренос на енергия в една или друга система.
Видове енергийни системи
Във физическия свят съществуват два вида енергийни системи. Затворена или затворена система има постоянна маса. В отворена или отворена система, масата може да намалее и да се увеличи в зависимост от процесите, протичащи в тази система. Повечето от наблюдаваните системи са отворени. 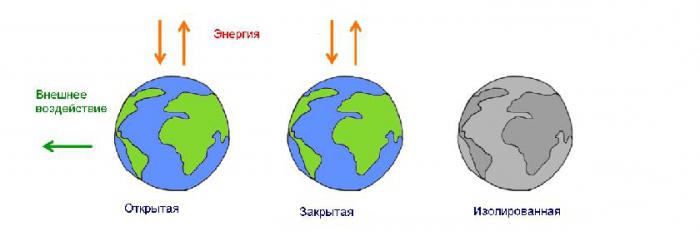 Изследванията в такива системи са възпрепятствани от множество случайни фактори, които влияят върху надеждността на резултатите. Ето защо физиците изучават явленията в затворени системи, екстраполирайки резултатите към отворени, като вземат предвид необходимите корекции.
Изследванията в такива системи са възпрепятствани от множество случайни фактори, които влияят върху надеждността на резултатите. Ето защо физиците изучават явленията в затворени системи, екстраполирайки резултатите към отворени, като вземат предвид необходимите корекции.
Изолирана енергийна система
Всяка затворена система, в която няма обмен на енергия с околната среда, е изолирана. Равновесното състояние на такава система се определя от индикациите за такива количества:
- P - налягане в системата;
- V е обемът на изолираната система
- Т е температурата;
- n е броят на моловете газ в системата;
Както се вижда, количеството топлина и извършената работа не са включени в този списък. Затворена, изолирана система не извършва топлообмен и не извършва работа. Нейната обща енергия остава непроменена.
Смяна на енергията на системата
Когато се извърши работа или се осъществи процес на топлообмен, състоянието на системата се променя и няма да се счита за изолирано.
Формулирането на първия закон на термодинамиката
Вътрешна енергия Затворената система се състои от сумата от енергиите на всички частици на тази система. Тази енергия може да се променя само чрез действие от системата отвън. Вътрешната енергия на такава затворена система ще се увеличи или поради работата, която е извършена в системата, или защото определено количество топлина се прехвърля към такава система. Намаляването на общата енергия на системата ще зависи и от два фактора - или ще излъчи топлина, или ще свърши някаква работа.
Промяната в обема на общата енергия може да се изрази с формула, която ще изглежда така: 
Ако говорим за извършената работа в системата, тогава променливата W ще бъде отрицателен. Тази формула представлява първият закон на термодинамиката.
Закон за опазване
Този закон се счита за един от основните закони на физиката. Топлината и работата са основно средство за пренос на енергия, а промяната във вътрешната енергия на системата директно зависи от тези количества. Така се променя първият закон на термодинамиката закон за запазване на енергията.
Първо, първият закон на термодинамиката е получен за изолирани системи. По-късно беше доказано, че законът е универсален и може да се приложи към отворени системи, ако правилно вземем предвид промяната във вътрешната енергия, която се дължи на колебанията в количеството на веществото в системата. Ако въпросната система преминава от състояние А в състояние Б, тогава работата, извършена от системата W и количеството топлина Q, ще се различават. Различните процеси дават неравномерни показания на тези променливи, дори ако системата в крайна сметка достигне първоначалното си състояние. Но разликата е W - Q винаги ще бъде същото. С други думи, ако след всяко въздействие системата се върне в първоначалното си състояние, то независимо от вида на процесите, участващи в преобразуването на такава система, се наблюдава правилото W - Q = const .
В някои случаи е по-удобно да се използва диференциалната формула за изразяване на първия закон. Изглежда така: dU = dW- dQ
тук dU - безкрайно малка промяна във вътрешната енергия
dW - стойност, характеризираща безкрайно малката работа на системата
dQ - безкрайно малко количество топлина, прехвърлена към тази система.
енталпия
За по-широко приложение на първия закон на термодинамиката се въвежда понятието енталпия.
Това е наименованието на общото количество на общата енергия на веществото и на продукта от обема и налягането. Физическата експресия на енталпията може да бъде представена със следната формула:
H = U + pV
Абсолютната стойност на енталпията е сумата от енталпиите на всички части, които съставляват системата. 
В количествено изражение тази стойност не може да бъде определена. Физиците работят само с разликата в енталпиите на крайното и първоначалното състояние на системата. В крайна сметка, за всички изчисления, промените в състоянието на системата избират определено ниво, на което потенциална енергия е равна на нула. По същия начин те правят при изчисляването на енталпията. Ако приложим понятието енталпия, тогава първият закон на термодинамиката за изопроцеси ще изглежда така: dU = dW- dH
Енталпията на всяка система зависи от вътрешната структура на веществата, които образуват тази система. Тези показатели от своя страна зависят от структурата на веществото, неговата температура, количество и налягане. За сложни вещества е възможно да се изчисли стандартната енталпия на образуването, която е равна на количеството топлина, което е необходимо за образуване на мол от вещество от прости компоненти. Като правило стандартната стойност на енталпията е отрицателна, тъй като при синтеза на сложни вещества в повечето случаи се отделя топлина.
Първият закон на термодинамиката в адиабатни процеси
Прилагането на първия закон на термодинамиката за изопроцеси може да се разглежда графично. Например, разгледайте адиабатния процес, при който количеството топлина остава постоянно през цялото време, т.е. Q = const . Такъв изопроцес протича в топлоизолирани системи, или за толкова кратко време, че системата няма време за извършване на топлообмен с външната среда. Бавното разширяване на газа в диаграмата за обемно налягане е описано чрез следната крива:
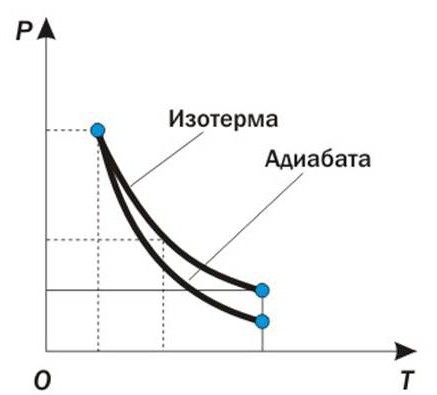
Според графика е възможно да се обоснове прилагането на първия закон на термодинамиката за изопроцеси. Тъй като няма промяна в количеството топлина в адиабатния процес, промяната във вътрешната енергия е равна на количеството произведена работа. dU = - dW
От това следва, че вътрешната енергия на системата намалява и неговата температура пада.
Примери за адиабатни процеси
Обратното също е вярно: намаляването на налягането при липса на топлообмен рязко увеличава температурата на системата. Приблизително така газът се разширява в двигателите с вътрешно горене. При дизеловите двигатели горимият газ се компресира 15 пъти. Краткосрочното повишаване на температурата позволява самозапалването на горивната смес. 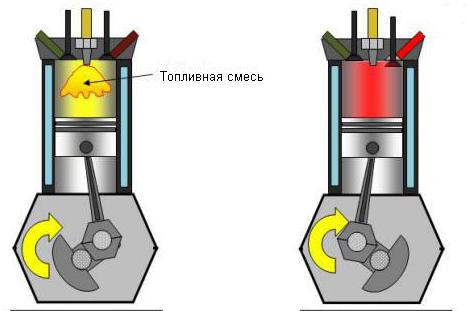
Друг пример за адиабатичния процес може да бъде разгледан - свободното разширяване на газовете. За да направите това, помислете за тази инсталация, състояща се от два резервоара: 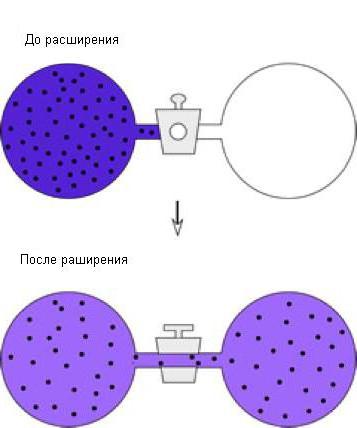
В първия резервоар има газ, във втория - липсва. Завъртайки кранчето, ние ще гарантираме, че газът ще запълни целия обем, определен за него. При достатъчна изолация на системата температурата на газа ще остане непроменена. Тъй като газът не е извършил никаква работа, променливата dW = const . Оказа се, че при равни други условия, температурата на газа намалява по време на разширяването. Разширяването на газа е неравномерно, следователно този процес не може да бъде представен на диаграмата за обем на налягането.
Първият закон на термодинамиката е универсален закон, който се прилага за всички видими процеси на Вселената. Дълбокото разбиране на причините за някои трансформации на енергия ни позволява да разберем съществуващите физически явления и да открием нови закони.