Химични свойства на водорода: характеристики и приложение
Помислете какво представлява водородът. Химичните свойства и подготовката на този неметален материал са изследвани в хода. неорганична химия в училище. Този елемент е оглавен от периодичната таблица на Менделеев и затова заслужава подробно описание.

Подробности за отваряне на елемент
Преди да разгледаме физичните и химичните свойства на водорода, ние откриваме как е открит този важен елемент.
Химиците, които са работили през шестнадесети и седемнадесети век, многократно са споменавали в своите писания за запалими газове, които се освобождават, когато са изложени на активни метали. През втората половина на осемнадесети век Г. Кавендиш успява да събере и анализира този газ, давайки му името "горим газ".
Физико-химичните свойства на водорода по това време не са изследвани. Едва в края на осемнадесети век А. Лавуазие успява да установи чрез анализ, че е възможно да се получи този газ чрез анализ на водата. Малко по-късно той започва да нарича новия елемент хидроген, което означава „раждане на вода”. Водородът дължи съвременното си руско име М. Ф. Соловьев.
Да бъдеш в природата
Химичните свойства на водорода могат да бъдат анализирани само въз основа на неговото разпространение в природата. Този елемент присъства в хидро- и литосферата, а също така е част от минералите: природен и свързан газ, торф, масло, въглища, горими шисти. Трудно е да си представим възрастен, който да не знае, че водородът е неразделна част от водата.
В допълнение, този неметал се среща при животни под формата на нуклеинови киселини, протеини, въглехидрати, мазнини. На нашата планета този елемент се намира в свободна форма доста рядко, може би, само в естествен и вулканичен газ.
Във формата на плазмата водородът съставлява около половината от масата на звездите и слънцето, още повече, че е част от междузвездния газ. Например, в свободна форма, както и под формата на метан, амоняк, този неметал присъства в състава на комети и дори на някои планети.
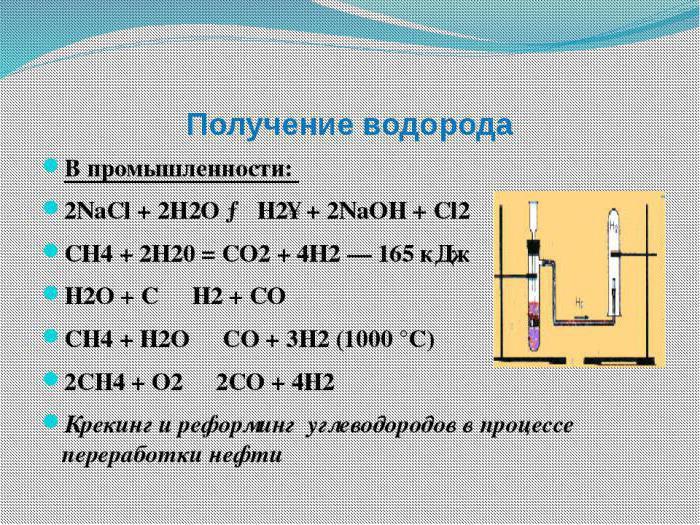
Физични свойства
Преди да разгледаме химичните свойства на водорода, отбелязваме, че при нормални условия това е газообразно вещество, по-леко от въздуха, имащо няколко изотопни форми. Той е почти неразтворим във вода, има висока топлопроводимост. Protium, с масов брой 1, се счита за най-лесната му форма. Тритий, който има радиоактивни свойства, се образува в природата от атмосферния азот, когато е изложен на неврони от UV лъчи.
Особености на структурата на молекулата
За да се разгледат химичните свойства на водорода, реакциите, характерни за него, ще засягат особеностите на неговата структура. В тази двуатомна молекула ковалентната неполярна химическа връзка. Образуването на атомен водород е възможно чрез взаимодействието на активни метали с киселинни разтвори. Но в тази форма този неметал може да съществува само за незначителен период от време, почти веднага се рекомбинира в молекулярна форма.

Химични свойства
Помислете за химичните свойства на водорода. В повечето от съединенията, които образува този химичен елемент, той проявява окислително състояние +1, което го прави подобен на активния (алкални) метали. Основните химични свойства на водорода, характеризиращи го като метал:
- взаимодействие с кислород за образуване на вода;
- реакция с халогени, придружена от образуването на водороден халогенид;
- получаване на сероводород, когато се комбинира със сяра.
По-долу е представено уравнението на реакциите, характеризиращи химичните свойства на водорода. Обръщаме внимание на факта, че като неметален (със степен на окисление -1), той действа само в реакцията с активни метали, образувайки с тях съответните хидриди.
Водородът при нормална температура неактивно взаимодейства с други вещества, така че повечето от реакциите се извършват само след предварително загряване.
Нека се спрем по-подробно на някои химични взаимодействия на елемента, който оглавява периодичната таблица на химичните елементи на Менделеев.
Реакцията на образуване на вода е съпроводена с отделяне на 285.937 kJ енергия. При повишени температури (повече от 550 градуса по Целзий) този процес е съпроводен със силна експлозия.
Сред тези химични свойства на газообразния водород, които са открили значително приложение в промишлеността, интерес представлява взаимодействието му с метални оксиди. Чрез каталитично хидрогениране в съвременната промишленост се обработват метални оксиди, например чист метал се извлича от железен оксид (смесен железен оксид). Този метод позволява ефективна обработка на метален скрап.
Синтезът на амоняк, който включва взаимодействието на водорода с въздушния азот, също се търси в съвременната химическа индустрия. Сред условията за възникване на това химично взаимодействие, ние отбелязваме налягането и температурата.

заключение
Това е водород, който е химикал от ниско ниво при нормални условия. С повишаването на температурата, неговата активност се увеличава значително. Това вещество се търси в органичния синтез. Например, чрез хидрогениране, кетоните могат да бъдат редуцирани до вторични алкохоли и алдехидите могат да бъдат превърнати в първични алкохоли. В допълнение, чрез хидрогениране е възможно да се трансформират ненаситените въглеводороди от клас етилен и ацетилен в граничните съединения на метановите серии. Водородът с право се счита за просто вещество в търсенето в модерното химическо производство.